Носитель катализатора — Википедия
Материал из Википедии — свободной энциклопедии
Носитель катализатора или подложка (катализатора) (англ. carrier или англ. support) — инертный или малоактивный материал, служащий для стабилизации на его поверхности частиц активной каталитической фазы.
Металлическая платина (показана стрелками), стабилизированная на носителе — оксиде алюминия.Роль носителя в гетерогенном катализе состоит в предотвращении агломерации или спекания активного компонента, что позволяет поддерживать высокую площадь контакта активного вещества (см. активная каталитическая фаза) и реагентов. Количество носителя, как правило, гораздо больше количества нанесенного на него активного компонента. Основными требованиями к носителям являются большая площадь поверхности и пористость, термическая стабильность, химическая инертность, высокая механическая прочность. В ряде случаев носитель влияет на свойства активной фазы (эффект «сильного взаимодействия металл–носитель»). В качестве носителей применяют как природные (глины, пемза, диатомит, асбест и др.), так и синтетические материалы (активные угли, силикагель, алюмосиликаты, оксиды алюминия, магния, циркония и др.).
- Chorkendorff I., Niemantsverdriet J.W. Concept of Modern Catalysis and Kinetics. — Weinheim: WILEY-VCH Verlag GmbH & Co. KGaA, 2003. — 452 p.
- Крылов О. В. Гетерогенный катализ. — М.: ИКЦ «Академкнига», 2004. — 679 с.
Катализатор — это… Что такое Катализатор?
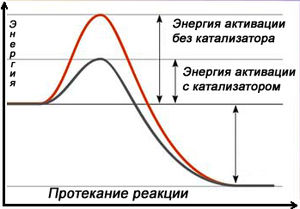 Схема протекания реакции с катализатором
Схема протекания реакции с катализаторомКатализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[1]. Количество катализатора, в отличие от реагентов, после реакции не изменяется. Важно понимать, что катализатор не участвует в реакции. Они обеспечивают более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется.
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO [1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов
, каждый из которых ускоряет разные стадии реакции [2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня (Имянитов).В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.[4]
Источники
- ↑ 1 2 3 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- ↑ Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- ↑ Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru. Архивировано из первоисточника 25 августа 2011.
См. также
Ссылки
Автомобильный катализатор и его роль в выхлопной системе
Катализатор имеет удивительно простое устройство, но воздействие его очень велико. Из этой статьи вы узнаете, какие загрязняющие вещества образуются в результате работы двигателя, и как каталитический преобразователь справляется с каждым из них, сокращая выбросы вредных выхлопных газов.
Автомобильные катализаторы
На дороги ежедневно выезжают миллионы автомобилей, и каждый из них — источник загрязнения воздуха. Особенно это чувствуется в крупных городах, где выхлопные газы автомобилей могут создавать большие проблемы.
Каталитический преобразователь или катализаторДля решения этих проблем каждая страна издает свои законы, которые ограничивают допустимый уровень загрязнения, который может создавать каждая машина. За прошедшее время автопроизводители внесли много улучшений в конструкцию автомобильного двигателя и топливных систем, чтобы соответствовать этим требованиям. Одно из значительных изменений произошло в 1975 году — именно в этом году появилось новое устройство, называемое каталитическим преобразователем (конвертером) или просто катализатором. Работа каталитического преобразователя заключается в преобразовании вредных выхлопных газов в менее вредные прежде, чем они покинут выхлопную систему автомобиля.
Выбросы загрязняющих веществ
В целях сокращения выбросов, современные автомобильные двигатели тщательно контролируют количество сжигаемого ими топлива. Их задача — сохранить соотношение «воздух-топливо» как можно ближе к идеальной точке, называемой стехиометрической. Теоретически, при этом соотношении все топливо сгорит с использованием всего имеющегося в воздухе кислорода. Для бензина стоихиометрический коэффициент — около 14,7:1, что значит, что при сожжении одной единицы бензина будет сожжено 17,4 единицы воздуха. фактически во время езды сгорание топливной смеси немного отличается от идеального соотношения. Иногда смесь может быть бедной (при коэффициенте «воздух-топливо» выше, чем 14,7), или, наоборот, насыщенной (при более низком коэффициенте).
Основные загрязняющие вещества, вырабатываемые двигателем, это:
- газообразный азот (N2) — воздух состоит на 78 процентов из газообразного азота, и большая часть его проходит сквозь автомобильный двигатель
- диоксид углерода (СО2
- водяной пар (H2O) — еще один продукт сгорания. Водород из топлива соединяется с кислородом воздуха.
Это выбросы в основе своей не опасны, хотя, как считается, выброс углекислого газа (СО2) способствует глобальному потеплению. Но так как процесс горения никогда не совершенен, небольшое количество гораздо более вредных выхлопных газов выделяется при работе двигателя автомобиля. Именно на снижение их уровня ориентированы каталитические преобразователи:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счет неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.
В следующем разделе мы рассмотрим, какие именно процессы происходят внутри каталитического преобразователя.
Как катализаторы сокращают вредные выбросы в выхлопных газах
Если вспомнить химию, то катализатор — это вещество, которое ускоряет или вызывает химическую реакцию, само не входя в продукты реакции. Катализаторы участвуют в реакции, но не являются не реактивом, ни продуктом реакции. Так, для человеческого организма естественным катализатором многих важных биохимических реакций являются ферменты.
В каталитических преобразователях существуют два различных типа катализаторов: восстанавливающий катализатор и окислительный катализатор. Оба типа состоят из керамической структуры, покрытой металлическим катализатором (обычно это платина, родий и/или палладий). Идея заключается в том, чтобы создать структуру, которая подставляет под поток выхлопных газов максимальную площадь катализатора и свести к минимуму задействованное при этом количество самого катализатора, так как используемые материалы весьма дороги. В некоторых преобразователях даже стали использовать золото с примесью более традиционных катализаторов. Золото дешевле по сравнению с остальными катализаторами, и может повысить степень окисления на 40 процентов, что необходимо для снижения количества вредных газов.
Большинство современных выхлопных систем в автомобилях оснащены тремя каталитическими преобразователями, по одному для каждого из веществ, выброс которых необходимо уменьшить.
Восстанавливающий катализатор — первый этап каталитического преобразователя. Он использует платину и родий чтобы уменьшить выбросы NOx. Когда молекула NO или NO2 встречается с молекулами катализатора, от нее отделяется атом азота, высвобождая кислород — O2. Атом азота же связывается с другим атомом азота, образуя N2.
Окислительный катализатор — второй этап каталитического преобразователя. Он снижает количество несгоревшего топлива и окиси углерода в результате их сжигания (окисления) с помощью таких катализаторов, как платина и палладий. Этот катализатор также помогает СО вступить в реакцию с несгоревшим кислородом, образуя углекислый газ СО2.
Существуют два основных вида конструкций, используемых в каталитическом преобразователе — это конструкция по типу «соты» и «керамические бусины». Большинство автомобилей используют сотовые структуры.
Следующий раздел посвещен третьей стадии процесса преобразования, и тому, как добиться от своего каталитического преобразователя лучшего результата.
Контроль загрязнения и повышение эффективности выхлопной системы
Третьим этапом преобразования является система управления, которая контролирует поток выхлопных газов и использует эту информацию для управления системой впрыска топлива. Один датчик кислорода установлен выше автомобильного катализатора, то есть ближе к двигателю, чем сам преобразователь. Этот датчик говорит компьютеру двигателя, сколько кислорода содержится в выхлопе. Компьютер двигателя уменьшает или увеличивает количество кислорода в выхлопных газах за счет регулировки количества воздуха, поступающего к топливу. Эта схема позволяет контролировать двигатель компьютера, чтобы убедиться, что двигатель работает на соотношении, близком к стехиометрической точке, а также чтобы убедиться, что в выхлопных газах достаточно кислорода для работы окислительного катализатора для окисления несгоревших углеводородов и СО.
Каталитический преобразователь проделывает большую работу по уменьшению загрязнения окружающей среды, но его производительность может быть существенно улучшена. Одним из недостатков является то, что каталитический преобразователь работает только при достаточно большой температуре. Когда вы только заводите машину, каталитический преобразователь почти не работает.
Простое решение этой проблемы состоит в том, чтобы передвинуть каталитический преобразователь ближе к двигателю. Тогда выхлопные газы, поступающие в каталитический преобразователь, будут более горячими,и он нагреется быстрее, но это одновременно сокращает срок службы конвертера из-за воздействия чрезмерно высоких температур. Большинство автопроизводителей размещает каталитический преобразователь под передним пассажирским сиденьем, достаточно далеко от двигателя, именно для того, чтобы высокие температуры не вредили ему.
Подогрев каталитического преобразователя — хороший способ снижения выбросов. Самый простой способ подогреть катализатор — использование электрических нагревателей. К сожалению, 12-вольтовая электрическая система, установленная на большинстве машин, не может нагреть каталитический преобразователь достаточно быстро. Большинство людей не будет ждать несколько минут, пока нагреется каталитический преобразователь. Гибридные машины имеют большие, высоковольтные батареи, которые могут достаточно быстро нагреть автомобильный катализатор.
Каталитические преобразователи дизельных двигателей плохо справляются с сокращением выбросов NOx. Одна из причин в том, что дизельные двигатели сами по себе функционируют в более низком температурном режиме, чем обычные, а преобразователи работают лучше при нагреве. Некоторые ведущие эксперты в области «зеленого» автомобилестроения придумали новую выхлопную систему, которая помогает исправить этот недостаток. Они впрыскивают водный раствор мочевины в выхлопную трубу до того, как газы достигнут преобразователя. При этом возникает химическая реакция, которая уменьшает количество NOx. Карбамид, также известный как мочевина — органическое соединение углерода, азота, кислорода и водорода. Его можно обнаружить в моче млекопитающих и земноводных, что и объясняет такое название. Мочевина реагирует с NOx с получением азота и водяного пара, снижая количество оксидов азота в выхлопных газах более чем на 90 процентов.
Источник: Авто Релиз.ру.Разница между Катализатором и Ингибитором
Ключевое различие между Катализатором и Ингибитором заключается в том, что Катализатор увеличивает скорость реакции, тогда как Ингибитор останавливает или уменьшает скорость реакции.
Катализаторы и Ингибиторы являются химическими соединениями. Эти две группы соединений проявляют противоположную активность в биологических и химических системах. Они участвуют в химических реакциях, но непосредственно не используются в них.
Содержание
- Обзор и основные отличия
- Что такое Катализатор
- Что такое Ингибитор
- В чем разница между Катализатором и Ингибитором
- Заключение
Что такое Катализатор?
Катализатор — это химическое соединение, которое может увеличить скорость реакции, но непосредственно не используется в ней. Следовательно, это соединение может продолжать действовать неоднократно. По этой причине для определенной химической реакции требуется только небольшое количество катализатора.
 Влияние катализатора на химическую реакцию
Влияние катализатора на химическую реакциюКатализатор обеспечивает альтернативный путь химической реакции, уменьшая энергию активации реакции. Здесь катализатор соединяется с реагентом для создания промежуточного продукта, и после завершения требуемой реакции катализатор покидает промежуточное соединение и регенерирует.
Существует два типа катализаторов, как гомогенные, так и гетерогенные катализаторы. В гомогенных катализаторах молекулы находятся в той же фазе, что и молекулы реагента. Однако в гетерогенных катализаторах молекулы находятся в фазе, отличной от фазы молекул реагента. Ферменты являются хорошим примером биологических катализаторов.
Что такое Ингибитор?
Ингибитор — это химическое соединение, которое может либо остановить, либо уменьшить скорость химической реакции. Поэтому их называюм «отрицательными катализаторами». Кроме того, это соединение может также снизить активность катализатора.
 Конкурентное и бесконкурентное ингибирование ферментов (красный — ингитор, зелёный — субстрат)
Конкурентное и бесконкурентное ингибирование ферментов (красный — ингитор, зелёный — субстрат)В отличие от катализаторов, эти соединения не обеспечивают пути реакции для снижения энергии активации. Роль ингибитора заключается либо в дезактивации катализатора, либо в удалении промежуточных продуктов реакции.
В чем разница между Катализатором и Ингибитором?
Катализатор — это химическое соединение, которое может увеличить скорость реакции не использующийся в ней, в то время как Ингибитор — это химическое соединение, которое может либо остановить, либо снизить скорость химической реакции. Таким образом, это ключевое различие между Катализатором и Ингибитором.
Кроме того, Катализаторы работают путем обеспечения альтернативного пути реакции путем получения промежуточного продукта реакции, в то время как Ингибиторы работают либо путем дезактивации катализатора, либо путем удаления промежуточных продуктов реакции.
Заключение — Катализатор против Ингибитора
Катализатор представляет собой химическое соединение, которое может увеличить скорость реакции, в то время как Ингибитор представляет собой химическое соединение, которое может либо остановить, либо уменьшить скорость реакции химической реакции. Ключевое различие между Катализатором и Ингибитором заключается в том, что Катализатор увеличивает скорость реакции, тогда как Ингибитор останавливает или уменьшает скорость реакции.
Какова роль катализатора в автомобиле?
Интенсивное развитие автомобильной промышленности и растущее желание иметь свои собственные «четыре колеса» вызвали довольно быстрый рост угрозы загрязнения атмосферы. Мы обнаружили, что выбросы от автотранспорта являются гораздо более вредными для человека, чем те, которые получены от промышленности. Это потому, что распространение загрязнения автомобилями происходит в высоких концентрациях и на малых высотах…
Автомобили являются крупнейшим источником загрязнения, потому что они выбрасывают более пятнадцати тысяч химических соединений, таких как газ и пыль.
Для снижения выбросов вредных веществ и химических веществ в атмосферу, были введены строгие правила разных видов. В результате сконструировано устройство, которое имеет научное название каталитический нейтрализатор, т.е. катализатор.
Таким образом, катализатор является важной и необходимой частью выхлопной системы не только автомобилей, но и других транспортных средств с двигателями внутреннего сгорания.
Катализатор представляет собой устройство, функция которого заключается в нейтрализации газов, которые выходят наружу через выхлопную систему. Благодаря катализатору присутствующие в выхлопах ядовитые соединения подвергаются различным химическим реакциям, например дожиганию.
В результате они выделяются из выхлопной трубы как нейтральные соединения. Функционирование нейтрализатора опирается на реакции составляющих, входящих в состав выхлопов с катализатором.
Итак, автомобильный катализатор выполняет функцию уменьшения количеств вредных выхлопов субстратов. Если двигатель делал полное сгорание топлива, катализатор не был бы нужен в автомобиле. Тогда выхлопная труба высвобождала бы воду или углекислый газ. Однако получить такую степень горения не представляется возможным.
Применяются различные виды катализаторов, учитывая разное содержание выхлопов в двигателях с искровым зажиганием и с воспламенением от сжатия. Среди катализаторов, используемых в настоящее время в автомобилях можно выделить окислительные, восстановительные и окислительно-восстановительные.
Роль окислительного катализатора заключается в переработке ядовитого углерода и углеводородов на пару, а также воду. Применяется он в двигателях с воспламенением от сжатия.
роль катализатора
В свою очередь если речь идет об окиси азота, которые остаются, то их удалением занимается восстановительный катализатор. Все чаще используются многофункциональные катализаторы. Действуют они трояко, поскольку устраняют всевозможные вредные составляющие выхлопов. Современные катализаторы могут исключить даже до 90% элементов.
Для правильной работы катализатора должны быть соблюдены определенные условия, поэтому используется лямбда-зонд. Это своего рода устройство, которое посылает обновленную информацию на компьютер, а также регулирует состав топливной смеси.
В старых моделях автомобилей отработанный катализатор удаляется без замены его на более новую модель. Это, безусловно, дешево, но не приемлемо, потому что не согласуется с законом. Его недостаток также приводит к быстрому износу глушителя и других частей выхлопной системы.
Таким образом, катализатор является важной частью оборудования для каждого автомобиля, так как благодаря ему наш автомобиль, как и среда, могут быть здоровее.
——Понравилась статья? Пожалуйста, поделитесь с друзьями. Спасибо 🙂
КАТАЛИЗ — это… Что такое КАТАЛИЗ?
Существенно, что третичные карбений-ионы более стабильны, чем первичные или вторичные. Вследствие этого на поверхности катализатора присутствуют в основном именно они, а потому основным продуктом изомеризации бутана является изобутан. Кислотные катализаторы широко применяются при переработке нефти — крекинге, алкилировании, полимеризации и изомеризации углеводородов
(см. также
).
Установлен механизм действия карбений-ионов, играющих роль катализаторов в этих процессах. При этом они участвуют в целом ряде реакций, включая образование малых молекул путем расщепления больших, соединение молекул (олефина с олефином или олефина с изопарафином), структурную перегруппировку путем изомеризации, образование парафинов и ароматических углеводородов путем переноса водорода. Одно из последних применений кислотного катализа в промышленности — получение этилированных топлив присоединением спиртов к изобутилену или изоамилену. Добавление кислородсодержащих соединений в бензин уменьшает концентрацию оксида углерода в выхлопных газах. Метил-трет-бутиловый эфир (МТБЭ) с октановым числом смешения 109 тоже позволяет получить высокооктановое топливо, необходимое для работы автомобильного двигателя с высокой степенью сжатия, не прибегая к введению в бензин тетраэтилсвинца. Организовано также производство топлив с октановыми числами 102 и 111.
Активность катализаторов обусловливается их основными свойствами. Давним и хорошо известным примером таких катализаторов является гидроксид натрия, применяющийся для гидролиза или омыления жиров при получении мыла, а один из последних примеров — катализаторы, используемые при производстве полиуретановых пластиков и пенопластов. Уретан образуется при взаимодействии спирта с изоцианатом, а ускоряется эта реакция в присутствии оснвных аминов. В ходе реакции происходит присоединение основания к атому углерода в молекуле изоцианата, в результате чего на атоме азота появляется отрицательный заряд и его активность по отношению к спирту повышается. Особенно эффективным катализатором является триэтилендиамин. Полиуретановые пластики получают при взаимодействии диизоцианатов с полиолами (полиспиртами). Когда изоцианат реагирует с водой, ранее образовавшийся уретан разлагается с выделением CO2. При взаимодействии смеси полиспиртов и воды с диизоцианатами образующийся пенополиуретан вспенивается газообразным CO2.
Эти катализаторы ускоряют реакции двух типов и дают лучшие результаты, чем при пропускании реагентов последовательно через два реактора, каждый из которых содержит только один тип катализатора. Это связано с тем, что активные центры катализатора двойного действия находятся очень близко друг к другу, и промежуточный продукт, образующийся на одном из них, тут же превращается в конечный продукт на другом. Хороший результат дает объединение катализатора, активирующего водород, с катализатором, способствующим изомеризации углеводородов. Активацию водорода осуществляют некоторые металлы, а изомеризацию углеводородов — кислоты. Эффективным катализатором двойного действия, который применяется при переработке нефти для превращения нафты в бензин, является мелкодисперсная платина, нанесенная на кислый глинозем. Конверсия таких составляющих нафты, как метилциклопентан (МЦП), в бензол повышает октановое число бензина. Сначала МЦП дегидрируется на платиновой части катализатора в олефин с тем же углеродным остовом; затем олефин переходит на кислотную часть катализатора, где изомеризуется до циклогексена. Последний переходит на платиновую часть и дегидрируется до бензола и водорода. Катализаторы двойного действия существенно ускоряют риформинг нефти. Их используют для изомеризации нормальных парафинов в изопарафины. Последние, кипящие при тех же температурах, что и бензиновые фракции, ценны тем, что обладают более высоким октановым числом по сравнению с неразветвленными углеводородами. Кроме того, превращение н-бутана в изобутан сопровождается дегидрированием, способствуя получению МТБЭ.
Важной вехой в истории катализа явилось открытие каталитической полимеризации a-олефинов с образованием стереорегулярных полимеров. Катализаторы стереоспецифической полимеризации были открыты К.Циглером, когда он пытался объяснить необычные свойства полученных им полимеров. Другой химик, Дж.Натта, предположил, что уникальность полимеров Циглера определяется их стереорегулярностью. Эксперименты по дифракции рентгеновских лучей показали, что полимеры, полученные из пропилена в присутствии катализаторов Циглера, высококристалличны и действительно имеют стереорегулярную структуру. Для описания таких упорядоченных структур Натта ввел термины «изотактический» и «синдиотактический». В том случае, когда упорядоченность отсутствует, используется термин «атактический»:
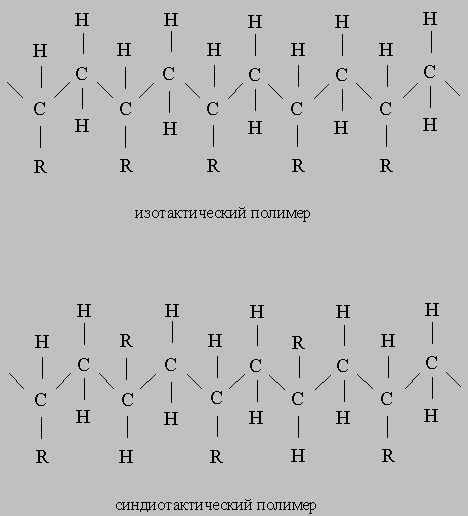
Стереоспецифическая реакция протекает на поверхности твердых катализаторов, содержащих переходные металлы групп IVA-VIII (такие, как Ti, V, Cr, Zr), находящиеся в неполностью окисленном состоянии, и какое-либо соединение, содержащее углерод или водород, который связан с металлом из групп I-III. Классическим примером такого катализатора является осадок, образующийся при взаимодействии TiCl4 и Al(C2H5)3 в гептане, где титан восстановлен до трехвалентного состояния. Эта исключительно активная система катализирует полимеризацию пропилена при обычных температуре и давлении.
Каталитическое окисление. Применение катализаторов для управления химизмом процессов окисления имеет большое научное и практическое значение. В некоторых случаях окисление должно быть полным, например при нейтрализации СО и углеводородных загрязнений в выхлопных газах автомобилей. Однако чаще нужно, чтобы окисление было неполным, например во многих широко применяемых в промышленности процессах превращения углеводородов в ценные промежуточные продукты, содержащие такие функциональные группы, как -СНО, -СООН, -С-СО, -СN. При этом применяются как гомогенные, так и гетерогенные катализаторы. Примером гомогенного катализатора является комплекс переходного металла, который используется для окисления пара-ксилола до терефталевой кислоты, эфиры которой служат основой производства полиэфирных волокон.
Катализаторы гетерогенного окисления. Эти катализаторы обычно являются сложными твердыми оксидами. Каталитическое окисление проходит в два этапа. Сначала кислород оксида захватывается адсорбированной на поверхности оксида молекулой углеводорода. Углеводород при этом окисляется, а оксид восстанавливается. Восстановленный оксид взаимодействует с кислородом и возвращается в исходное состояние. Используя ванадиевый катализатор, неполным окислением нафталина или бутана получают фталевый ангидрид.
Получение этилена путем дегидродимеризации метана. Синтез этилена посредством дегидродимеризации позволяет превращать природный газ в более легко транспортируемые углеводороды. Реакцию 2Ch5 + 2O2 -> C2h5 + 2h3O проводят при 850° С с использованием различных катализаторов; наилучшие результаты получены с катализатором Li-MgO. Предположительно реакция протекает через образование метильного радикала путем отщепления атома водорода от молекулы метана. Отщепление осуществляется неполностью восстановленным кислородом, например О22-. Метильные радикалы в газовой фазе рекомбинируют с образованием молекулы этана и в ходе последующего дегидрирования превращаются в этилен. Еще один пример неполного окисления — превращение метанола в формальдегид в присутствии серебряного или железомолибденового катализатора.
Цеолиты. Цеолиты составляют особый класс гетерогенных катализаторов. Это алюмосиликаты с упорядоченной сотовой структурой, размер ячеек которой сравним с размером многих органических молекул. Их называют еще молекулярными ситами. Наибольший интерес представляют цеолиты, поры которых образованы кольцами, состоящими из 8-12 ионов кислорода (рис. 2). Иногда поры перекрываются, как у цеолита ZSМ-5 (рис. 3), который используется для высокоспецифичного превращения метанола в углеводороды бензиновой фракции. Бензин содержит в значительных количествах ароматические углеводороды и поэтому имеет высокое октановое число. В Новой Зеландии, например, с помощью этой технологии получают треть всего потребляемого бензина. Метанол же получают из импортируемого метана.
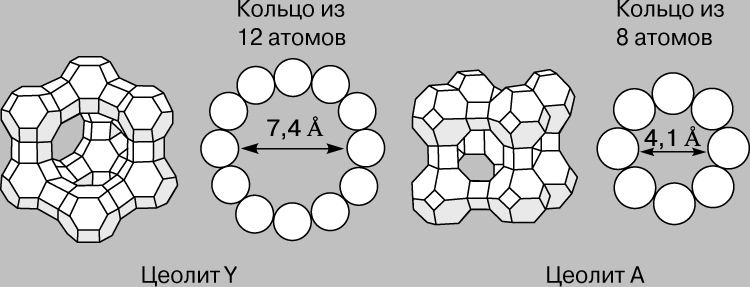
Рис. 2. СТРУКТУРА ЦЕОЛИТОВ с большими и малыми порами.

Рис. 3. ЦЕОЛИТ ZSM-5. Схематическое представление структуры в виде пересекающихся трубок.
Катализаторы, составляющие группу Y-цеолитов, существенно повышают эффективность каталитического крекинга благодаря в первую очередь своим необычным кислотным свойствам. Замена алюмосиликатов цеолитами позволяет увеличить выход бензина более чем на 20%. Кроме того, цеолиты обладают селективностью в отношении размера реагирующих молекул. Их селективность обусловлена размером пор, через которые могут проходить молекулы лишь определенных размеров и формы. Это касается как исходных веществ, так и продуктов реакции. Например, вследствие стерических ограничений пара-ксилол образуется легче, чем более объемные орто- и мета-изомеры. Последние оказываются «запертыми» в порах цеолита (рис. 4).
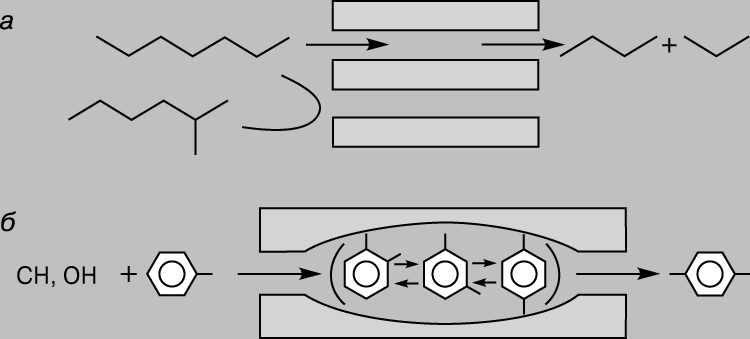
Рис. 4. СХЕМА, объясняющая селективность цеолитов в отношении реагентов (а) и продуктов (б).
Применение цеолитов произвело настоящую революцию в некоторых промышленных технологиях — депарафинизации газойля и машинного масла, получении химических полупродуктов для производства пластмасс алкилированием ароматических соединений, изомеризации ксилола, диспропорционировании толуола и каталитическом крекинге нефти. Особенно эффективен здесь цеолит ZSM-5.
Катализаторы и охрана окружающей среды. Применение катализаторов для уменьшения загрязнения воздуха началось в конце 1940-х годов. В 1952 А. Хаген-Смит установил, что углеводороды и оксиды азота, входящие в состав выхлопных газов, реагируют на свету с образованием оксидантов (в частности, озона), которые оказывают раздражающее действие на глаза и дают другие нежелательные эффекты. Примерно в это же время Ю.Хоудри разработал способ каталитической очистки выхлопных газов путем окисления CO и углеводородов до CO2 и Н2О. В 1970 была сформулирована Декларация о чистом воздухе (уточненная в 1977, расширенная в 1990), согласно которой все новые автомобили, начиная с моделей 1975, должны снабжаться каталитическими нейтрализаторами выхлопных газов. Были установлены нормы для состава выхлопных газов. Поскольку соединения свинца, добавляемые в бензин, отравляют катализаторы, принята программа поэтапного отказа от них. Обращалось внимание и на необходимость снижения содержания оксидов азота. Специально для автомобильных нейтрализаторов созданы катализаторы, в которых активные компоненты нанесены на керамическую подложку с сотовой структурой, через ячейки которой проходят выхлопные газы. Подложку покрывают тонким слоем оксида металла, например Al2O3, на который наносят катализатор — платину, палладий или родий. Содержание оксидов азота, образующихся при сжигании природных топлив на теплоэлектростанциях, можно уменьшить добавлением в дымовые газы малых количеств аммиака и пропусканием их через титанованадиевый катализатор.
Ферменты. Ферменты — это природные катализаторы, регулирующие биохимические процессы в живой клетке. Они участвуют в процессах энергообмена, расщеплении питательных веществ, реакциях биосинтеза. Без них не могут протекать многие сложные органические реакции. Ферменты функционируют при обычных температуре и давлении, обладают очень высокой селективностью и способны увеличивать скорость реакций на восемь порядков. Несмотря на эти преимущества, лишь ок. 20 из 15 000 известных ферментов применяются в широких масштабах. Человек тысячелетиями использовал ферменты при выпечке хлеба, получении алкогольных напитков, сыра и уксуса. Сейчас ферменты применяются и в промышленности: при переработке сахара, получении синтетических антибиотиков, аминокислот и белков. Протеолитические ферменты, ускоряющие процессы гидролиза, добавляют в детергенты. С помощью бактерий Clostridium acetobutylicum Х. Вейцман осуществил ферментативное превращение крахмала в ацетон и бутиловый спирт. Этот способ получения ацетона широко использовался в Англии во время Первой мировой войны, а во время Второй мировой войны с его помощью в СССР изготавливали бутадиеновый каучук. Исключительно большую роль сыграло применение ферментов, продуцируемых микроорганизмами, для синтеза пенициллина, а также стрептомицина и витамина B12. Этиловый спирт, получаемый ферментативным путем, широко используют в качестве автомобильного топлива. В Бразилии более трети из примерно 10 млн. автомобилей работают на 96%-ном этиловом спирте, получаемом из сахарного тростника, а остальные — на смеси бензина и этилового спирта (20%). Хорошо отработана технология производства топлива, представляющего собой смесь бензина и спирта, в США. В 1987 из зерен кукурузы было получено ок. 4 млрд. л спирта, из них примерно 3,2 млрд. л было использовано в качестве топлива. Разнообразное применение находят и т.н. иммобилизованные ферменты. Эти ферменты связаны с твердым носителем, например силикагелем, над которым пропускают реагенты. Преимущество этого метода состоит в том, что он обеспечивает эффективное контактирование субстратов с ферментом, разделение продуктов и сохранение фермента. Один из примеров промышленного использования иммобилизованных ферментов — изомеризация D-глюкозы во фруктозу.
ТЕХНОЛОГИЧЕСКИЕ АСПЕКТЫ
Современные технологии невозможно представить без применения катализаторов. Каталитические реакции могут протекать при температурах до 650° С и давлениях 100 атм и более. Это заставляет по-новому решать проблемы, связанные с контактированием между газообразными и твердыми веществами и с переносом частиц катализатора. Чтобы процесс был эффективным, при его моделировании необходимо учитывать кинетические, термодинамические и гидродинамические аспекты. Здесь широко используются компьютерное моделирование, а также новые приборы и методы контроля за технологическими процессами. В 1960 был достигнут значительный прогресс в производстве аммиака. Применение более активного катализатора позволило понизить температуру получения водорода при разложении водяного пара, благодаря чему удалось понизить давление и, следовательно, уменьшить производственные затраты, например за счет применения более дешевых центробежных компрессоров. В результате стоимость аммиака упала более чем вдвое, произошло колоссальное увеличение его производства, а в связи с этим — увеличение производства пищевых продуктов, поскольку аммиак — ценное удобрение.
Методы. Исследования в области катализа проводят с использованием как традиционных, так и специальных методов. Применяются радиоактивные метки, рентгеновская, инфракрасная и рамановская (КР) спектроскопия, электронно-микроскопические методы; проводятся кинетические измерения, изучается влияние способов получения катализаторов на их активность. Большое значение имеет определение площади поверхности катализатора по методу Брунауэра — Эммета — Теллера (метод БЭТ), основанному на измерении физической адсорбции азота при разных давлениях. Для этого определяют количество азота, необходимого для образования монослоя на поверхности катализатора, и, зная диаметр молекулы N2, вычисляют суммарную площадь. Помимо определения общей площади поверхности проводят хемосорбцию разных молекул, что позволяет оценить число активных центров и получить информацию об их свойствах. В распоряжении исследователей имеются разные методы изучения структуры поверхности катализаторов на атомном уровне. Уникальную информацию позволяет получить метод EXAFS. Среди спектроскопических методов все шире применяются УФ-, рентгеновская и оже-фотоэлектронная спектроскопия. Большой интерес представляет масс-спектрометрия вторичных ионов и спектроскопия ионного рассеяния. Для исследования природы каталитических комплексов применяются измерения ЯМР. Сканирующий туннельный микроскоп позволяет увидеть расположение атомов на поверхности катализатора.
ПЕРСПЕКТИВЫ
Масштабы каталитических процессов в промышленности увеличиваются с каждым годом. Все более широкое применение находят катализаторы для нейтрализации веществ, загрязняющих окружающую среду. Возрастает роль катализаторов в производстве углеводородов и кислородсодержащих синтетических топлив из газа и угля. Весьма перспективным представляется создание топливных элементов для экономичного преобразования энергии топлива в электрическую энергию. Новые концепции катализа позволят получать полимерные материалы и другие продукты, обладающие многими ценными свойствами, усовершенствовать методы получения энергии, увеличить производство пищевых продуктов, в частности путем синтеза белков из алканов и аммиака с помощью микроорганизмов. Возможно, удастся разработать генно-инженерные способы получения ферментов и металлоорганических соединений, приближающихся по своей каталитической активности и селективности к природным биологическим катализаторам.
ЛИТЕРАТУРА
Гейтс Б.К. Химия каталитических процессов. М., 1981 Боресков Г.К. Катализ. Вопросы теории и практики. Новосибирск, 1987 Ганкин В.Ю., Ганкин Ю.В. Новая общая теория катализа. Л., 1991 Токабе К. Катализаторы и каталитические процессы. М., 1993
Энциклопедия Кольера. — Открытое общество. 2000.
Химические реакции роль катализатора — Справочник химика 21
Эта первая стадия метаболизма состоит из 11 последовательных химических реакций, в которых глюкоза превращается во фруктозу, а затем в два производных глицеринового альдегида, содержащих три атома углерода. Лишь на одной-двух последних стадиях процесс разветвляется на различные маршруты, приводящие к пировиноградной кислоте, молочной кислоте, этанолу или ацетону. Каждая стадия гликолиза регулируется собственным катализатором, роль которого выполняет фермент с молекулярной массой 30000-500000. [c.327]Каким образом катализатор может влиять на химическую реакцию Если принять, что катализатор в заметной степени при реакции не расходуется, то термодинамически можно показать, что его роль в реакции не заключается в изменении точки равновесия, а сводится к ускорению достижения равновесия. Однако в большинстве химических систем имеются метастабильные состояния, обладающие свободной энергией, промежуточной между свободной энергией реагирующих веществ и состоянием равновесия. Мы можем приписать специфичность катализатора его свойству увеличивать скорость достижения одного из таких промежуточных состояний, а не общему ускорению в направлении достижения состояния с наименьшей энергией. Так как катализатор влияет на скорость реакции и не влияет на состояние равновесия, невозможно дать общее кинетическое описание поведения катализаторов. Болес полно проанализировать поведение катализатора можно, только зная конкретный механизм, по которому протекает данная реакция. Однако целесообразно провести классификацию катализаторов по строению и связанному с ним действию катализаторов на тип реакций, протекающих по данному механизму. Для твердых тел обычно принимают следующую классификацию [c.531]
Как мы видим, катализатор представляет собой вещество, которое ускоряет химическую реакцию, обеспечивая более легкий путь ее протекания, но само не расходуется в реакции. Это не означает, что катализатор не принимает участия в реакции. Молекула РеВгз играет важную роль в многостадийном механизме рассмотренной выше реакции бромирования бензола. Но в конце реакции РеВгз регенерируется в исходной форме. Это является общим и характерным свойством любого катализатора. Смесь газов Н2 и О2 может оставаться неизменной при комнатной температуре целые годы, и в ней не будет протекать сколько-нибудь заметной реакции, но внесение небольшого количества платиновой черни вызывает мгновенный взрыв. Платиновая чернь оказывает такое же воздействие на газообразный бутан или пары спирта в смеси с кислородом. (Некоторое время назад в продаже появились газовые зажигалки, в которых вместо колесика и кремня использовалась платиновая чернь, однако они быстро приходили в негодность вследствие отравления поверхности катализатора примесями в газообразном бутане. Тетраэтилсвинец тоже отравляет катализаторы, которые снижают загрязнение атмосферы автомобильными выхлопными газами, и поэтому в автомобилях, на которых установлены устройства с такими катализаторами, должен использоваться бензин без примеси тетраэтилсвинца.) Каталитическое действие платиновой черни сводится к облегчению диссоциации двухатомных молекул газа, адсорби- [c.303]
Расчеты константы равновесия химической реакции и изменения энергии Гиббса играют важную роль в оценке химической концепции нового метода, поскольку дают возможность определить максимально возможное количество целевого продукта. Отрицательный итог расчета заставляет отказаться от рассматриваемого процесса или искать новый способ проведения химического превращения, например, используя рециркуляцию, введение вспомогательного исходного вещества и т. д. Положительные результаты расчета еще не гарантируют возможности использования предложенного метода (скорость реакции может быть очень мала для промышленных целей), но указывают на то, что нужно провести соответствующее исследование (отыскать катализатор, ускоряющий превращение, и т. д.). [c.154]
Исключительно важную роль играют процессы комплексообра-зования в биологических системах. Образование комплексов реа-1 ирующих веществ с биологическими катализаторами — ферментами — является необходимой стадией огромного большинства химических реакций, протекающих в живых клетках. [c.35]
Для каждой реакции имеется свой наилучший катализатор. В химическом производстве роль катализаторов исключительно велика. Получение серной кислоты, синтетического топлива, синтез аммиака, переработка нефти и природного газа, получение искусственного каучука, пластмасс, гидрогенизация жиров — вот перечень важнейших производств, где применяются катализаторы. Очевидно, поиски и подбор новых, более активных катализаторов повлекут за собой повышение производительности труда и снижение себестоимости продукции. [c.86]
Известно, что в любом химическом процессе, особенно в гетерогенном, явления переноса вещества и энергии играют существенную роль, В большинстве случаев стремление к оптимальному проведению процессов сводится к тому, чтобы обеспечить условия достижения режима химической кинетики. Для этого создают интенсивную конвекцию среды, облегчают доступ реагентов к активным поверхностям за счет измельчения катализаторов или нанесения на соответствующие носители и т. д. В результате уменьшается сопротивление процессам переноса и устраняется влияние последних на химическую реакцию. [c.186]
Роль полупроницаемой перегородки, пропускающей молекулы сорта О, выполняет исчерпывающая часть колонны, где также чистота продукта О ограничена только эффективностью этой части. Укрепляющая и исчерпывающая части колонны одновременно обеспечивают возврат реагентов А и В в среднюю часть колонны — реакционную зону, в которой созданы условия для протекания химической реакции. Основным условием в рассматриваемом случае является размещение катализатора в реакционной зоне. Укрепляющая часть колонны одновременно будет возвращать в реакционную зону тяжелокипящий продукт О, а исчерпывающая часть — продукт С. [c.200]
Наконец, важнейшую роль играет и сам катализатор, способ его приготовления и т, д. Добавление различных модификаторов нли применение смесей оксидов и солей способно сильно изменять активность и селективность контакта. Так, некоторые каталитические яды (галогены, селен), дезактивируя серебряный катализатор окисления этилена, существенно повышают его селективность. Оксиды молибдена и висмута, в индивидуальном виде вызывающие полное сгорание олефинов, в форме молибдата висмута (В120з МоОз = 1 2) являются селективными катализаторами гетерогенного окисления пропилена. Большое влияние оказывают носитель, размер зерен катализатора, его пористость и т. д. Ввиду возможности последовательного окисления целевого вещества и высокой скорости самой химической реакции на поверхности катализатора переход процесса во внутридиффузиоиную область весьма нежелателен, поэтому используют катализаторы с небольши.ми зернами и сравнительно крупными порами. [c.416]
Термодинамика не дает никаких сведений о времени, необходимом для достижения равновесия это уже неоднократно подчеркивалось выше. Термодинамика лишь сопоставляет исходное и конечное состояние реагирующей системы, характеризуя их такими функциями состояния, как Т, Р, V, Е, Я, 5 и С. Изменения этих величин не зависят от того, протекает реакция за наносекунду (10 с) или за эон (10 лет), а также от того, осуществляется реакция в одну стадию или в тысячу стадий, при условии что исходное и конечное состояния системы в каждом случае одни и те же. В отличие от этого кинетика занимается изучением скорости протекания реакций. Камень, скатывающийся по склону горы, останавливается и остается сколь угодное время неподвижным, если он встречает на своем пути барьер, высота которого может составлять даже небольшую часть высоты самой горы. Если этот камень будет случайно потревожен прохожим, вероятность того, что за определенный промежуток времени он перескочит через препятствие и продолжит скатываться с горы, зависит среди прочих факторов и от высоты барьера. Задачей химической кинетики является исследование барьеров химических реакций и установление их роли в замедлении реакций, а также путей преодоления барьеров при надлежащих химических условиях или их обхода при помощи катализаторов. [c.393]
Ранее уже указывалось, что ферменты — это белки, выполняющие