Понятие катализатор: Катализатор — это… Что такое Катализатор? – 6.2. Понятие о катализе и катализаторах
6.2. Понятие о катализе и катализаторах

6. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
6.1. Скорость химической реакции и влияние на нее различных факторов
Р е ш е н и е. По правилу Вант-Гоффа
Vt 2 |
| t 2 −t1 | t | t | |
| ; 8 = 2 10 ; 2 3 | = 2 10 ; ∆t = 30 °C. | |||
= γ | 10 | ||||
V | |||||
|
|
|
| ||
t1 |
|
|
|
| |
Значительное изменение скорости реакции с изменением температуры объясняет теория активации. Согласно этой теории в химическое взаимо-
действие вступают только активные молекулы, обладающие повышенным уровнем энергиии, достаточной для осуществления данной реакции. Неактивные молекулы можно сделать активными, если сообщить им необходимую дополнительную энергию. Этот процесс называется активацией. Один из способов активации – увеличение температуры: при повышении температуры число активных молекул возрастает, благодаря чему резко увеличивается скорость реакции.
Энергия, которую надо сообщить молекулам реагирующих веществ, чтобы превратить их в активные, называется энергией активации. Ее определяют опытным путем, обозначают буквой Еа и обычно выражают в кДж/моль. Например, для соединения водорода и йода
h3 + J2 = 2HJ Еа = 167,4 кДж/моль,
а для реакции распада иодоводорода
2HJ = h3 + J2 Еа = 186,2 кДж/моль.
Энергия активации Еа зависит от природы реагирующих веществ и служит характеристикой каждой реакции. Скорость реакции непосредственно зависит от значения энергии активации: если она мала, то за определенное время протекания реакции энергетический барьер преодолеет большее количество частиц и скорость реакции будет высокой, но если энергия активации велика, то реакция идет медленно.
При взаимодействии ионов энергия активации очень мала и ионные реакции протекают с очень большой скоростью, практически мгновенно.
Увеличить скорость реакции можно с помощью катализаторов. Применять катализаторы выгоднее, чем повышать температуру, тем более, что ее повышение далеко не всегда возможно.
Катализаторами называются вещества, изменяющие скорость химической реакции, но сохраняющие при этом свои свойства и состав. Сам катализатор в реакциях не расходуется и в конечные продукты не входит.
Одни катализаторы ускоряют реакцию – положительный катализ, или просто катализ, другие замедляют – отрицательный катализ. Примером положительного катализа может служить получение серной кислоты из оксида
Химия. Учеб. пособие | -66- |

6.ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
6.2.Понятие о катализе и катализаторах
серы (IV) или окисление аммиака в азотную кислоту с помощью платинового катализатора.
Примером отрицательного катализа является замедление взаимодействия раствора сульфита натрия с кислородом воздуха в присутствии этилового спирта или уменьшение скорости разложения пероксида водорода в присутствии небольших количеств серной кислоты. Отрицательный катализ часто называют ингибированием, а отрицательные катализаторы, снижающие скорость реакции, – ингибиторами (механизм действия последних отличен от действия катализаторов).
Химические реакции, протекающие при участии катализаторов, называются каталитическими. Различают два вида катализа – гомогенный (однородный) и гетерогенный (неоднородный) катализ.
При гомогенном катализе реагирующие вещества и катализатор образуют однофазную систему – газовую или жидкую, между катализатором и реагирующими веществами отсутствует поверхность раздела. Например, каталитическое разложение пероксида водорода в присутствии раствора солей (жидкая фаза). Для гомогенного катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора.
При гетерогенном катализе реагирующие вещества и катализатор образуют систему из разных фаз. В этом случае между катализатором и реагирующими веществами существует поверхность раздела. Обычно катализатор
– твердое вещество, а реагирующие вещества – газы или жидкость. Примером может служить окисление аммиака (газообразная фаза) в присутствии платины (твердая фаза). Все реакции при гетерогенном катализе протекают на поверхности катализатора. Поэтому активность твердого катализатора зависит и от свойств его поверхности (размера, химического состава, строения и состояния). На поверхности катализатора имеются активные центры, реагирующие вещества адсорбируются на них, происходит деформация молекул, ослабевают связи между атомами и молекулы становятся активными.
Механизм действия катализаторов обычно объясняют образованием промежуточных соединений с одним из реагирующих веществ. Рассмотрим схему действия катализатора на следующем примере:
1.Основной химический процесс:
А+ В = АВ; SO2 + ½O2 = SO3
2.Образование промежуточного соединения одного из исходных веществ с катализатором NO:
К+ В = КВ; NO + ½O2 = NO2
3.Взаимодействие промежуточного соединения со вторым исходным веществом и освобождение катализатора:
КВ + А = АВ + К; NO2 + SO2 = SO3 + NO (катализатор)
Химия. Учеб. пособие | -67- |
6.ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
6.2.Понятие о катализе и катализаторах
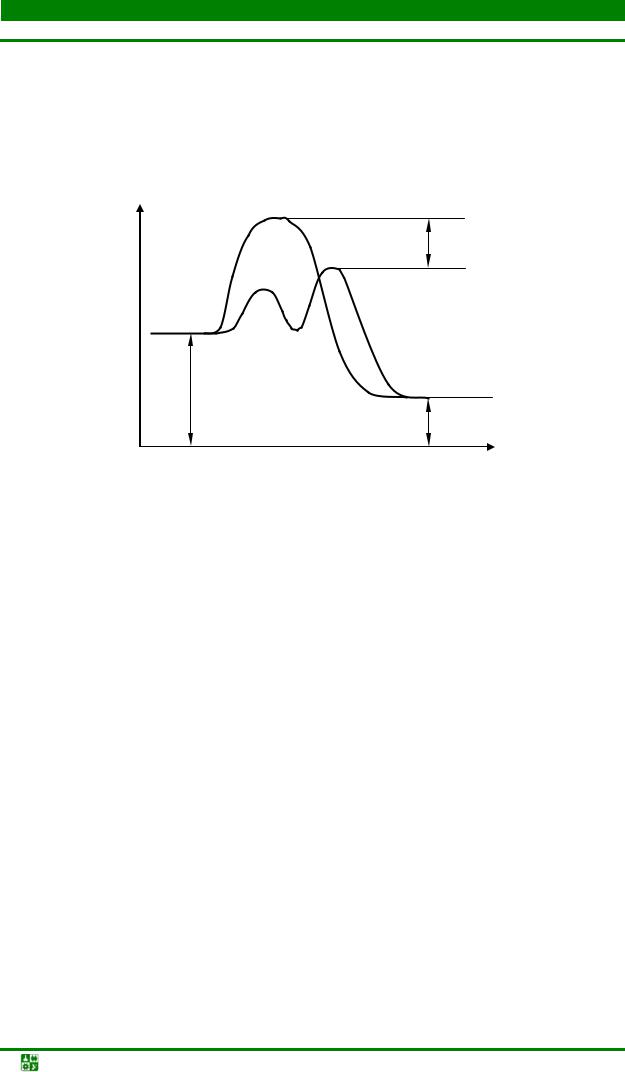
Катализатор разбивает ход химической реакции на несколько стадий. Соответственно, у каждой стадии имеется свой энергетический барьер. В сумме он составляет энергию активации Еа. За счет снижения энергетических барьеров по стадиям реакции протекают с большими скоростями (рис. 6.2).
А +КВ → [А…КВ]# (активированный комплекс) → АВ + К
G | [A…B]# |
| |
| ( G)# |
| [B…AK] # |
| [A…K]# |
A+B
A+B+K AK
AB
Gисходное
Gконечное
Рис. 6.2. Энергетическая схема хода реакции при отсутствии и в присутствии катализатора
Некоторые вещества снижают или полностью уничтожают активность твердого катализатора. Такие вещества называются каталитическими ядами. В качестве примера можно привести соединения мышьяка, ртути, свинца, цианистые соединения, к которым особенно чувствительны платиновые катализаторы.
Однако имеются и такие вещества, которые усиливают действие катализаторов, хотя сами катализаторами не являются. Эти вещества называются промоторами (промотирование платиновых катализаторов добавками железа, алюминия и др.).
Следует особо отметить, что действие катализаторов избирательно, поэтому из одного и того же вещества можно получить разные продукты.
Особую роль играют биологические катализаторы – ферменты. При их участии протекают сложные химические процессы в растительных и животных организмах.
6.3. Колебательные реакции
Существуют химические реакции, при протекании которых происходит периодическое изменение концентраций реагирующих веществ. Наибо-
лее известной колебательной реакцией является реакция Белоусова – Жаботинского, впервые исследованная в 60-х гг. ХХ в. Эта реакция представляет
Химия. Учеб. пособие | -68- |

6.ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
6.3.Колебательные реакции
собой каталитическое окисление малоновой кислоты Ch3(COOH)2 броматионом BrO 3− в присутствии иона германия Ge4+ в кислом водном растворе.
Колебания концентраций заметны по периодическому исчезновению и появлению желтой окраски, вызванной ионами Ge4+. Также периодически изменяются температура и концентрации других продуктов, являющихся интермедиатами (Br–, Br2). Для объяснения колебательных изменений предложен механизм, включающий следующие стадии:
1.BrO3− + Br– + 2H+ → HBrO2 + HBrO
2.HBrO2 + Br– + H+ → 2HBrO
3.BrO3− + HBrO2 + 2Ge3+ + 3H+ → 2HBrO2 + 2Ge4+ + h3O
4.2HBrO2 → BrO3− + HBrO + H+
5.nGe4+ + BrCH(COOH)2 → nGe3+ + продукты окисления.
Броммалоновая кислота образуется в результате реакции
Ch3(COOH)2 + HBrO → BrCH(COOH)2 + h3O
Общее уравнение имеет вид
2 BrO3− + 3Ch3(COOH)2 + 2H+ → 2BrCH(COOH)2 + 3CO2 + 4h3O
Это наиболее упрощенный вариант механизма. Более поздние модели включают 22-стадийные химические процессы в растительных и животных организмах.
6.4. Химическое равновесие и его смещение
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака:
3h3 (г) + N2 (г) →← 2Nh4 (г) ∆H = −46,2 кДж/моль.
В технике обратимые реакции, как правило, невыгодны. Поэтому различными методами (изменением температуры, давления и др.) их делают практически необратимыми.
Реакции, которые протекают только в одном направлении и завершаются полным превращением реагирующих веществ в конечные вещества, на-
зываются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
Химия. Учеб. пособие | -69- |

6.ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
6.4.Химическое равновесие и его смещение
2KClO3 → 2KCl + 3O2 ↑
Необратимых реакций не так много. Большинство реакций являются обратимыми.
Необратимыми называют такие реакции, при протекании которых:
1. Образующиеся продукты уходят из сферы реакции – выпадают в виде осадков или выделяются в виде газа, например:
BaCl2 + h3SO4 → BaSO4↓ + 2HCl
Na2CO3 + 2HCl→ 2 NaCl + CO2↑ + h3O
2. Образуется малодиссоциирующее соединение, например, вода:
HCl + NaOH → h3O + NaCl
3. Реакция сопровождается большим выделением энергии, например, горение магния:
2Mg + O2↑ → 2MgO, ∆H = − 602,5 кДж.
4.Образуется комплексное соединение.
Вуравнениях необратимых реакций между правой и левой частями ставится знак равенства или одна стрелка.
Под химическим равновесием понимается такое состояние обратимой реакции, когда скорости прямой и обратной реакции равны.
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия, например:
h3 (г) + J2 (г) →← 2HJ (г)
В состояния равновесия прямая и обратная реакции не прекращаются. Поэтому такое равновесие называется подвижным или динамическим.
Используя закон действия масс, напишем выражение для скоростей прямой и обратной реакций:
| → | → | ] [J2 |
| ← | ← |
|
|
| ||
| V = k[h3 | ]; V = k[HJ]2 , |
| ||||||||
|
|
| → | ← |
|
|
|
|
|
| |
если в состоянии равновесия V = V , то |
|
|
|
|
| ||||||
|
| ← |
|
|
| ← | [HJ]2 , |
| |||
|
| k =[Н2 ] [J2 | ]= k |
| |||||||
или |
|
|
|
|
|
|
|
|
| ||
| → | [HJ]2 |
|
|
|
| [HJ]2 |
|
| ||
| k | = | , | Kp = | . | ||||||
| ← | [h3 ] [J2 ] | [h3 ] [J2 ] | ||||||||
| k |
|
|
|
| ||||||
Химия. Учеб. пособие | -70- |

6.ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
6.4.Химическое равновесие и его смещение
→ ←
Отношение К/ К называется константой химического равновесия (обозначается Кр), которая постоянна при данной температуре, зависит от температуры и природы реагирующих веществ и не зависит от концентрации.
Химическое равновесие наступает при постоянстве внешних условий (давлении, концентрации, температуре). Изменение этих условий нарушает равновесие и вызывает увеличение скорости прямой или обратной реакции. Через некоторое время снова наступает равновесие. Переход реакционной системы от одного состояния равновесия к другому называется смещением (или сдвигом) химического равновесия.
Направление смещения химического равновесия при изменении концентрации реагирующих веществ, температуры и давления (в случаях газовых реакций) определяется общим положением, известным под названием принципа подвижного равновесия или принципа Ле Шателье: если на сис-
тему, находящуюся в равновесии, оказать какое-либо внешнее воздействие (изменить концентрацию, температуру, давление), то равновесие сместится в том направлении, где оказанное воздействие уменьшится.
Поясним это на примере следующей реакции:
→ | 2Nh4 (г) | ∆H = −92,4 кДж. |
3Н2 (г) + N2 (г) ← | ||
3 объема 1 объем | 2 объема |
|
Влияние концентрации на смещение равновесия. Если внешнее воздей-
ствие выражается в увеличении концентрации азота или водорода (исходных веществ), равновесие смещается к аммиаку, т. е. в сторону прямой реакции, протекающей с получением продуктов реакции. Соответственно, увеличение концентрации аммиака смещает равновесие в сторону исходных веществ.
Влияние температуры на смещение равновесия. При повышении тем-
пературы равновесие смещается в сторону эндотермической реакции, протекающей с поглощением тепла, а при понижении температуры – в сторону экзотермической реакции, идущей с выделением тепла. В данном случае повышение температуры смещает равновесие в сторону обратной реакции, т. к. эта реакция идет с выделением тепла ( Н < 0).
Влияние давления на смещение равновесия. Чтобы определить влияние давления на смещение равновесия, необходимо подсчитать число молей газообразных веществ в правой и левой частях уравнения. В приведенном примере в левой части уравнения содержится четыре моля газов, а в правой – один. Если понижать давление, то равновесие сместится в сторону возрастания числа молей газа (4 объема), т. е. в обратном направлении. Если увеличить давление, то равновесие сместится в сторону меньшего объема (2 моль вещества), т. е. в прямом направлении.
Если же в уравнении обратимой реакции число молей газов в левой части равно числу молей в правой части, например,
N2 (г) + O2 (г) →← 2NO (г)
то изменение давления не вызывает смещения химического равновесия.
Химия. Учеб. пособие | -71- |
Понятие о катализе и катализаторах
Одно из наиболее сильных средств влияния на скорость реакции – присутствие в реагирующей системе катализатора. Катализатором называется вещество, изменяющее скорость химической реакции, но остающееся неизменным после того, как химическая реакция заканчивается.
Катализ– явление, заключающееся в изменении скорости химической реакции под действием катализаторов. Согласно современным воззрениям, катализ обусловлен уменьшением энергии активации молекул (Ea1 ) при их контакте с катализатором (Ea2 ) так, как это показано нарис. 4.9:
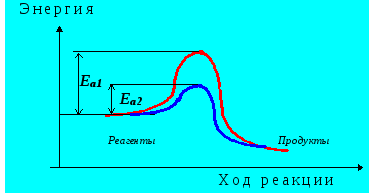
Рис. 4.9. Изменение энергии реагирующей системы в присутствии катализатора и без него.
Действие катализаторов является избирательным. Применяя разные катализаторы, можно получить из одного и того же вещества разные продукты, например:
Определенный катализатор, изменяя скорость одной реакции, совершенно не оказывает влияния на скорость другой химической реакции. Поэтому должно быть понятным, что поиски, подбор, исследование и дальнейшее внедрение в практику все новых и новых катализаторов является одной из сложнейших и важнейших задач современной химии, так как роль катализаторов в химическом производстве очень велика. Перечислим лишь несколько химических производств, где используют катализаторы.
В нефтяной промышленности для крекинга углеводородов (с помощью которого увеличивается выход бензина из керосина) и для реформинга (который приводит к перестройке структуры углеводородов и повышению октанового числа бензина).
При переработке природного газа.
При получении полимеров, искусственного каучука.
При получении серной кислоты, аммиака, синтетического метилового и этилового спиртов и т.д.
Катализ играет большую роль не только в химии, но и в биологии, так как практически все биохимические превращения, происходящие в живых организмах, являются каталитическими. В роли катализаторов в этом случае выступают ферменты – вещества биологического происхождения. Теория биохимических катализаторов – ферментов намного сложнее, чем теория химических катализаторов.
Реакционная способность веществ
Как мы уже видели, способность к взаимодействию различных химических реагентов (реакционная способность) определяется не только их атомно-молекулярной структурой, но и условиями протекания химических реакций, к которым прежде всего относятся термодинамические факторы, характеризующие зависимость реакций от температуры, давления и некоторых других условий. В еще большей степени характер и особенно скорость реакций зависят от кинетических условий, которые определяются, прежде всего, наличием катализатора.
Еще в конце XIX в. изучалось влияние растворителей на ход химических реакций. Выяснилось, что одна и та же реакция в разных растворителях протекает по-разному – с разными скоростями и выходом конечного продукта. Иногда растворитель оказывается инициатором реакции, – без него она просто не начиналась бы. В настоящее время считается общепринятым, что растворитель – непосредственный участник всякой химической реакции, является в одних случаях ее катализатором, т. е. веществом, ускоряющим реакции, а в других – ингибитором – веществом, снижающим скорость химического процесса.
Опыты показывают, что стенки реактора участвуют в химическом взаимодействии реагентов.
На интенсивность химических процессов оказывают влияние случайные примеси. Вещества различной степени чистоты проявляют себя в одних случаях как более активные реагенты, в других – как инертные. Примеси могут оказывать как каталитическое, так и ингибиторное действие. Поэтому для управления химическим процессом в реагирующие вещества вносят те или иные добавки.
Таким образом, влияние растворителей, стенок реактора и случайных примесей на ход химических реакций может быть сведено и к катализу, т. е. к положительному воздействию на химический процесс, и к ингибированию, сдерживающему процесс.
Говоря о катализаторах, следует отметить особый тип катализаторов, созданных самой природой, ферменты, или биокатализаторы. Без них возникновение и эволюция жизни на Земле были бы невозможны.
Несмотря на то, что ферменты обладают общими свойствами, присущими всем катализаторам, они не тождественны им, поскольку функционируют в рамках живых систем. Поэтому все попытки использовать опыт живой природы для ускорения химических процессов в неорганическом мире наталкиваются на серьезные ограничениями. Речь может идти только о моделировании некоторых функций ферментов и использования этих моделей для теоретического анализа деятельности живых систем, а также частично – практического применения выделенных ферментов для ускорения некоторых химических реакций.
Тот факт, что катализ играл решающую роль в переходе от химических систем к биологическим в процессе биохимической эволюции (возникновения жизни на Земле), в настоящее время подтвержден многими данными и аргументами. Наиболее убедительные результаты связаны с опытами по самоорганизации химических систем, которые наблюдали наши соотечественники Б.П. Белоусов и А.М. Жаботинский. Такие реакции сопровождаются образованием специфических пространственных и временных структур за счет поступления новых и удаления использованных реагентов. Важное значение в указанных реакциях играют каталитические процессы. Роль этих процессов усиливается по мере усложнения состава и структуры химических систем. На этом основании некоторые ученые напрямую связывают химическую эволюцию с самоорганизацией и саморазвитием каталитических систем.
катализатор — это… Что такое катализатор?
катализатор — ускоритель, энзим, фермент Словарь русских синонимов. катализатор сущ., кол во синонимов: 11 • биокатализатор (1) • … Словарь синонимов
КАТАЛИЗАТОР — КАТАЛИЗАТОР, вещество, которое способствует ускорению химической реакции, однако не участвует в ней. Многие промышленные процессы основываются на действии катализаторов, например, в ПРОЦЕССЕ ГАБЕРА по производству АММИАКА катализатором служит… … Научно-технический энциклопедический словарь
КАТАЛИЗАТОР — КАТАЛИЗАТОР, катализатора, муж. (см. катализ) (хим.). Вещество, ускоряющее или замедляющее химическую реакцию, само при этом не изменяющееся. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
КАТАЛИЗАТОР — КАТАЛИЗАТОР, а, муж. (спец.). Вещество, изменяющее скорость химической реакции. | прил. катализаторный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
катализатор — вещество, ускоряющее или замедляющее реакцию, но остающееся при этом неизменным. Биол. К. являются ферменты. (Источник: «Микробиология: словарь терминов», Фирсов Н.Н., М: Дрофа, 2006 г.) … Словарь микробиологии
КАТАЛИЗАТОР ФС-26/6 — катализатор, применяемый в составе песчано смоляных смесей при изготовлении стержней с фенолокарбамидными связующими в нагреваемой оснастке. Представляет собой водный раствор карбамида, хлористого и бромистого аммония и уротропина. Прозрачная… … Металлургический словарь
катализатор — Вещество, изменяющее скорость химических реакций. [ГОСТ Р 51953 2002] Тематики крахмал и крахмалопродукты … Справочник технического переводчика
катализатор — – вещество, влияющее на скорость химической реакции или возбуждающее ее, но в конечном итоге остающееся неизменным и неизрасходованным. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Катализатор — вещество, ускоряющее химическую реакцию, не будучи реагентом или продуктом реакции. [Ушеров Маршак А. В. Бетоноведение: лексикон. М.: РИФ Стройматериалы. 2009. – 112 с.] Рубрика термина: Общие термины Рубрики энциклопедии: Абразивное… … Энциклопедия терминов, определений и пояснений строительных материалов
КАТАЛИЗАТОР — вещество, ускоряющее хим. реакцию. Вещество, замедляющее реакцию называют (см.). К. дают новые направления хим. реакции, они могут образовывать с реагирующими веществами промежуточные соединения, однако сами не входят в состав конечных продуктов … Большая политехническая энциклопедия
Катализатор — (Catalyst) Определение катализатора, механизм действия катализатора Определение катализатора, механизм действия катализатора, применение катализатора Содержание Содержание 1. в химии Виды катализаторов Механизм действия катализаторов Требования,… … Энциклопедия инвестора
Определение катализатор общее значение и понятие. Что это такое катализатор
Катализатор — это то, что позволяет развивать процесс каталитического превращения . Поэтому, чтобы понять концепцию, мы должны знать, что такое катализ . Это слово, которое происходит от греческого языка, относится к химическим изменениям, которые генерируются веществами, которые не претерпевают изменений в ходе реакции .
Следовательно, для химии катализатор — это класс веществ, которые во время катализа изменяют развитие реакции. Катализаторы, которые увеличивают скорость реакции, называются положительными катализаторами, а катализаторы, которые вызывают снижение скорости, классифицируются как отрицательные катализаторы .
Катализатор, с другой стороны, это имя, данное каталитическим нейтрализаторам, которые есть в некоторых двигателях внутреннего сгорания. Эти элементы имеют целью контролировать выбросы газов, поступающих от взрывного двигателя.
Катализатор обычно состоит из керамического куска, состоящего из каналов, которые покрыты родием или другим материалом. В автомобилях катализатор расположен в зоне выхлопной трубы. Благодаря катализатору можно уменьшить выброс вредных газов, таких как окись углерода, более чем на семьдесят процентов.
Когда эти газы вступают в контакт с катализатором, происходит химическая реакция, которая позволяет газам разлагаться и окислять их, делая их безвредными для человека .
Как катализатор достигает этой выгоды? Принципиально потому, что в результате химической реакции они превращают углеводороды в воду и окись углерода в углекислый газ. И все это благодаря высоким температурам, при которых газы подвергаются воздействию упомянутого элемента, который сейчас нас занимает.
Тепловой экран, упругая защита, керамическая структура или нержавеющая коробка — это основные части каталитического нейтрализатора, которые иногда могут выходить из строя или ломаться, что приводит к соответствующим проблемам для автомобиля.
В случае, если у вас есть сомнения в том, что это может быть не в оптимальных условиях, необходимо проверить, возникают ли такие ситуации, которые дают понять, что требуется ремонт или замена:
• Рядом с выходным отверстием для газов образуется густой дым.
• Запах, который выходит из вышеупомянутой трубки автомобиля, пахнет очень странно.
• Шумы металлического типа слышны на нижней части автомобиля.
• Двигатель не работает должным образом и выходит из строя, как в процессе ускорения, так и в режиме холостого хода.
• Заметна нехватка энергии.
• Очень повторным образом двигатель автомобиля глохнет.
Все эти ситуации показывают, что катализатор забит, что он находится в плохом состоянии или что произошла поломка его керамической части. Следовательно, необходимо прибегнуть к мастерской для исчерпывающего анализа.
Использование катализаторов также присутствует в других секторах помимо транспортных средств. В настоящее время проводятся исследования в области сельского хозяйства, пищевой промышленности и производства кожгалантереи для превращения углекислого газа в органические компоненты, которые могут использоваться в различных производственных процессах.
Общие сведения о катализе и катализаторах
План лекции:
1 Краткая теория катализа
2 Требования, предъявляемые к катализаторам
3 Стадии каталитических реакций
4 Краткая характеристика каталитических реакций
1 Краткая теория катализа
Увеличение объёма производства нефтепродуктов, расширение их ассортимента и улучшение качества – основные задачи, поставленные перед нефтеперерабатывающей промышленностью в настоящее время. Возрастание доли переработки сернистых и высокосернистых нефтей, а также высокопарафинистых нефтей потребовало изменение технологии переработки нефти. Большое значение приобрели вторичные процессы. Производство топлив, отвечающих современным требованиям, невозможно без применения таких процессов как КК, КР, ГО, алкилирование, изомеризация и гидрокрекинг.
Катализ (этот термин впервые был предложен шведским химиком Берцелиусом в 1855г) является исключительно эффективным методом осуществления в промышленности химических превращений. В настоящее время до 90% всей химической продукции мира изготовляется каталитическим путём.
Катализ – многостадийный физико-химический процесс избирательного механизма и скорости термодинамически возможных химических реакций веществом-катализатором, образующим с участниками реакций промежуточные химические соединения.
Различают положительный катализ — увеличение скорости реакции под влиянием катализатора — и отрицательный катализ, приводящий к уменьшению скорости химического превращения (ингибирование).
Следует отметить, что под термином «катализ» подразумевают преимущественно только положительный катализ.
Важной особенностью катализа является:
1) сохранение катализатором своего состава, в результате промежуточных химических взаимодействий с реагирующими веществами.
2) Катализатор не расходуется в процессе катализа. Но под влиянием реагентов, примесей, циркуляция и температура катализатора всегда претерпевает физико-химические изменения. В этой связи в промышленных каталитических процессах предусматривают операции замены, периодической или непрерывной регенерации катализатора.
3) Катализатор не может влиять на термодинамическое равновесие химической реакции.
4) специфичность действия катализатора. Многие катализаторы проявляют каталитическую активность в отношении одной или узкой группы реакции. Для каждой реакции целесообразно использовать свой наиболее активный и селективный катализатор.
Классификация катализа и каталитических реакций
По агрегатному состоянию реагирующих веществ и катализатора различают:
— гомогенный катализ, когда реагенты и катализатор находятся в одной фазе;
— гетерогенный катализ, когда каталитическая система включает несколько фаз. В нефтепереработке гетерогенный катализ, особенно с твердым катализатором, распространен значительно больше, чем гомогенный.
По природе промежуточного взаимодействия реагирующих веществ и катализаторов катализ подразделяется на три класса:
1) гомолитический катализ — когда химическое взаимодействие протекает по гомолитическому механизму.
По гомолитическому, преимущественно так называемому электронному катализу протекают реакции окислительно-восстановительного типа (такой катализ поэтому часто называют окислительно-восстановительным):
— гидрирования,
— дегидрирования,
— гидрогенолиза гетероорганических соединений нефти,
— окисления и восстановления в производстве элементной серы,
— паровой конверсии углеводородов в производстве водорода,
— гидрирования окиси углерода до метана и др.
Каталитической активностью в отношении таких реакций обладают переходные металлы первой подгруппы (Сu, Ag) и восьмой группы (Fe, Ni, Co, Pt, Pd) периодической системы Д. И. Менделеева, их окислы и сульфиды, их смеси (молибдаты никеля, кобальта, ванадаты, вольфраматы, хроматы), а также карбонилы металлов и др.
Пример: С6Н14 → С6Н12 +Н2
2) гетеролитический — в случае гетеролитической природы промежуточного взаимодействия.
Гетеролитический, или так называемый ионный, катализ, имеет место в каталитических реакциях крекинга, изомеризации, циклизации, алкилирования, деалкилирования, полимеризации углеводородов, дегидратации спиртов, гидратации олефинов, гидролиза и многих других химических и нефтехимических процессах.
К катализаторам ионных реакций относят жидкие и твердые кислоты и основания (по этому признаку гетеролитический катализ часто называют кислотно-основным): H2SO4, HF, HCl, Н3РО4, HNO3, СН3СООН, AlCl3, BF3, SbF3, окислы алюминия, циркония, алюмосиликаты, цеолиты, ионообменные смолы, щелочи и др.
Пример: RCH=CH2 + H+A— → RC+HCH3 + A—
a) RC+HCH3 → RCH2 – C+H2 – первичный карбений-ион
б) RC+HCH3 → RC+H – CH3 – вторичный карбений-ион
3) бифункциональный (сложный) катализ, включающий оба типа химического взаимодействия.
В техническом катализе (например, в процессах каталитического риформинга и гидрокрекинга) нашли широкое применение бифункциональные катализаторы, состоящие из носителя кислотного типа (окись алюминия, алюмосиликаты, промотированные галоидами, цеолитом и др.) с нанесенным на него металлом — катализатором гемолитических реакций (Pt, Pd, Co, Ni, Mo и др.)
Ценность этой классификации заключается в том, что именно природа промежуточного химического взаимодействия, а не агрегатное состояние реакционной системы определяет свойства, которыми должен обладать активный катализатор.
Пример: С6Н14 (-Н2)  С6Н12
С6Н12 ц-С6Н12 (-3Н2)
ц-С6Н12 (-3Н2)  С6Н6
С6Н6
Теплота образования первичных карбений-ионов на 81 кДж/моль больше, чем для вторичных, и на 142 кДж/моль больше, чем для третичных. Вследствие этого, первичные карбений-ионы быстро переходят в третичные.
Обсуждение:Катализатор — Википедия
Материал из Википедии — свободной энциклопедии
Внешние воздействия нельзя относить к катализаторам:
1.Катализатор – это вещество, количество и состояние которого в ходе реакции не изменяются, см. в ВИКИ Катализ.
2. Катализатор – это вещество, изменяющее скорость реакции, но не входящее в состав продуктов (Химическая энциклопедия. Т.2, 1990, С.337).
3. Catalysis is the process in which the rate of a chemical reaction is increased by means of a chemical substance known as a catalyst. Unlike other reagents that participate in the chemical reaction, a catalyst is not consumed. Thus, the catalyst may participate in multiple chemical transformations, although in practice catalysts are sometimes consumed in secondary processes («Википедия» на английскком, статья «Catalysis»).
4. Если к катализаторам отнести внешние воздействия, ускоряющие реакцию, то катализаторами придётся считать температуру (нагрев) и перемешивание!
Про недостатки термина «Отрицательный катализ» см. в новом варианте статьи.
Наум 13:58, 11 августа 2008 (UTC)
1. Катализатор, это вещество, количество которого не изменяется в ходе реакции, а его состояние изменяется, так как происходит перегруппировка атомов и молекул на поверхности носителя катализатора. Так же может происходить вынос активных веществ с поверхности носителя в ряде последовательных реакций закоксования.
2. Катализатор не относиться к внешним воздействиям и совершенно не грамотно говорить, что «катализатор присутствует в реакционной среде» или «в присутствии катализатора», потому что это не инерт, а вещество непосредственно вступающее в реакцию.
Eenium 19:39, 24 декабря 2009 (UTC)
Если я правильно понимаю химию процесса, то в гетерогенном катализе катализатор не образует промежуточной связи, т.е. не вступает в химическую реакцию ни с одним из реагентов, но позволяет за счёт физического взаимодействия с реагентами обеспечить бОльшую интенсивность из взаимодействия между собой, таким образом катализатор не обязан проходить фазу промежуточного соединения и статья неверно сформулирована, поскольку говорит исключительно о гомогенном катализе. Frank 15:16, 20 февраля 2012 (UTC)
о термине «гомогенный катализатор»[править код]
Насколько корректно использовать термин «гомогенный катализатор»? Речь идет о катализаторе, присутствующем в гомогенной среде. Но это — гомогенный катализ, а не катализатор. Рассмотрим пример — гидрирование этилена на платине. Катализатор гомогенный — однородная платина, непрерывная пластина или проволока, а сама реакция идет в гетерогенных условиях — на границе раздела гомогенной платины и гомогенной газовой смеси. Считаю, что термин «гомогенный катализатор» надо заменить на «катализатор гомогенной реакции» (аналогично — «гетерогенный катализатор»). 194.44.31.30 13:04, 27 августа 2015 (UTC)СВК
Противоположное понятие?!![править код]
WTF?!
Понятие о катализаторе | Химия. Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Попав на царапину или ранку, пероксид водорода разлагается намного интенсивнее (сильно пузырится, «шипит»). Кислород в момент выделения обладает сильными дезинфицирующими свойствами. Вместе с пеной из ранки удаляется загрязнение. Это происходит потому, что кровь содержит особые вещества, которые ускоряют разложение пероксида водорода. В 1835 г. шведский химик И. Берцелиус установил, что в присутствии определенных веществ скорость некоторых химических реакций существенно возрастает. Для таких веществ он ввел термин «катализатор» (греч. katalysis — «ослабление», «разрушение»).
Катализаторы — вещества, которые ускоряют химические реакции, но не входят в состав их продуктов.
Ферменты — биологические катализаторы, они ускоряют химические реакции в живых организмах.
Разложение пероксида водорода могут ускорять многие вещества. Среди них — оксид марганца (IV) — один из продуктов разложения перманганата калия. Щепотка этого соединения ускоряет разложение все новых и новых порций пероксида водорода. Сам оксид марганца (IV) при этом не расходуется и не входит в состав продуктов реакции (рис. 18.6).
| Рис. 18.5. Схема получения кислорода разложением пероксида водорода и собирания кислорода вытеснением воздуха |
| Рис. 18.6. Каталитическое разложение пероксида водорода |
Кислород немного тяжелее воздуха. Поэтому его можно собрать вытеснением воздуха в сосуд, размещенный отверстием вверх (рис. 18.5).
Катализаторы играют важную роль в жизни человека. Ферменты принимают участие в регуляции биохимических процессов. С давних времен ферментативные процессы применяют в хлебопечении, сыроварении, виноделии, пивоварении, кожевничестве и т. п.
И сейчас ферменты применяют в промышленности: при переработке сахара, получении синтетических антибиотиков и белков. В моющие средства добавляют ферменты, которые ускоряют расщепление загрязнений белковой природы. Универсальные стиральные порошки для эффективного удаления пятен от пота, крови, пищевых продуктов и других белковых загрязнений содержат биодобавки и ферменты (их еще называют «энзимы»). Материал с сайта http://worldofschool.ru
| Рис. 18.7. Изготовление сыра невозможно без применения ферментов |
| Рис. 18.8. Схема очистки автомобильных выхлопных газов |
Важная черта современной практической химии — осуществление процессов с использованием катализаторов. Без них, например, невозможно превратить растительное масло в маргарин.
Каталитические методы очищения газообразных отходов промышленных предприятий применяют для удаления разнообразных токсичных соединений.
Также катализаторы нужны для очистки автомобильных выхлопных газов (рис. 18.8).
На этой странице материал по темам:Значение катализаторов в жизни человека
Сообщение краткое о катализаторах
Оціни значення каталізаторів у житті людини
Катализаторы в жизни человека
Реферат на тему катализаторы,понятие,их роль в жизни человека
Назови вещества, в которые превращаются составляющие автомобильных выхлопных газов после каталитической очистки.
Есть ли среди продуктов каталитической очистки выхлопных газов ядовитые вещества?
Оцени значение катализаторов в жизни человека.