Как устроен катализатор: 403 — Доступ запрещён – Каталитический нейтрализатор: устройство и принцип работы
Катализатор — Википедия
 Схема протекания реакции с катализатором
Схема протекания реакции с катализаторомКатализа́тор — химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции.
Ингибитор не является противоположным понятием, так как расходуется в ходе реакции[источник не указан 115 дней].
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества[1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным
.Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции[2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня[2].
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- ↑ 1 2 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- ↑ 1 2 Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- ↑ Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
- ↑ Автомобильный катализатор и его роль в выхлопной системе (неопр.). AutoRelease.ru. Архивировано 25 августа 2011 года.
Назначение и расположение катализатора в автомобиле
Практически с самого начала создания автомобиля и до сегодня у конструкторов стоит несколько вопросов, над которыми они постоянно «бьются». Один из этих вопросов – максимальное снижение выбросов вредных веществ в атмосферу, ведь при сгорании топлива в цилиндрах двигателя появляется отработанные газы, которые в своем составе имеют ядовитые элементы. А поскольку эти газы отводятся во внешнюю среду – значит, отравляющие вещества выходят из силовой установки авто постоянно, пока она работает.
Одним из самых действенных способов снижения вредных выбросов авто, который является вполне распространенным – использование каталитического нейтрализатора, в народе называющийся сокращенно катализатором.
Для того чтобы понять, для чего нужен этот нейтрализатор, упомянем немного теории.
Теоретическая часть
Содержание статьи
Устройство автомобильного катализатора
Выхлопной газ, выходящий из цилиндров силового агрегата состоит из многих элементов, выделившихся в результате химической реакции, которой и является горение. Некоторые из этих элементов вполне безвредны, а вот такие как окись углерода (СО), углеводороды (СН) и оксиды азота (NO и NO2) являются достаточно опасными. Чтобы уменьшить их содержание в выхлопе двигателя, ученые решили эти химические соединения еще раз подвергнуть хим. реакции. Для этого им пришлось использовать дорогостоящие металлы — платиноиридиевый сплав, палладий, родий. Вступая с ними в реакцию, вредные химические элементы окисляются, из-за чего после реакции на выходе получаются углекислый газ (CO2) и азот (N2) – вещества вполне безвредные. Конечно, полностью ядовитые элементы катализатор удалить не способен, но значительно уменьшить их – вполне.
Даже стандарты ЕВРО, постоянно ожесточающиеся, подразумевают определенное наличие опасных веществ, которые автомобили не должны превышать. В некоторых странах за экологией следят очень серьезно, поэтому авто, не соответствующие определенным нормам ЕВРО, и не оснащенные катализаторами, продавать и использовать запрещено.
Несколько слов о металлах, которые выступают нейтрализаторами. Они отличаются по химической реакции с вредными веществами. Так, палладий и сплав на основе платины являются окислительными, то есть, при вступлении в реакцию с вредными веществами, они их окисляют, разделяя на безвредные вещества.
Родий же является нейтрализатором восстановительным. Он при реакции оксиды азота восстанавливает до обычного безвредного азота.
На деле все происходит так: выхлопные газы и выпускного коллектора подаются в емкость, где находится специальная бобина с нейтрализующим металлом, проходя через которую, часть вредных веществ химически нейтрализуется, а затем уже выхлопной газ идет дальше – в резонатор и глушитель.
Сейчас все чаще применяются все три металла в одном катализаторе на авто – для улучшенной очистки отработанных газов. То есть, внутри катализатора размещаются одна за другой три бобины, каждая со своим металлом.
Конструкция катализатора
А теперь более подробно об устройстве катализатора. Располагается он зачастую за выпускным коллектором. Состоит он из корпуса, утеплителя и блок-носителя – той самой бобины.
О корпусе особо говорить нечего – герметичная жестяная емкость с двумя выходами для установки ее в систему отвода выхлопных газов. Утеплитель предотвращает просачивание газов мимо блок-носителя. Помимо этого, он сохраняет температуру, необходимую для протекания реакций. Дело в том, что быстрее всего реакции, при которых нейтрализуются вредные вещества проходят при температуре не менее 300 град. Поэтому зачастую нейтрализатор и располагается сразу за коллектором.
Принцип работы катализатора
А вот сами блок-носители по конструкции довольно интересны. Указанные металлы являются очень дорогостоящими, поэтому сделать один блок-носитель полностью из этого металла – удовольствие невыгодное. Поэтому основой для блок-носителя выступает керамика, сделанная в виде сотов. На поверхность этих сотов и наносится слой нейтрализующих металлов. Такая конструкция позволяет не только снизить расход дорогих металлов, но еще и по максимуму увеличить площадь контакта металла с газами.
Некоторые блок-носители состоят из свернутой в рулон керамической ленты с сотами, поэтому в разрезе она похожа на бобину. Но это не всегда так, есть и блок-носители, похожий на сигаретный фильтр, но только значительно увеличенный в размерах.
Работа катализатора
Одной из особенностей использования катализатора на авто является то, что бортовой компьютер следит за его работой. Для этого в систему отвода включены лямбда-зонды. В авто, которое не оснащено катализатором, данный зонд только один и нужен он для определения количества остаточного кислорода в отработанных газах для коррекции работы системы питания.
Расположение катализатора в выхлопной системе. Кислородные датчики — это и есть лямбда-зонды
А вот в машине с каталитическим нейтрализатором таких лямбда-зондов два, первый установлен перед и катализатором и он определяет состав выхлопных газов для системы питания. Второй располагается за катализатором и определяет он состав выхлопных газов уже прошедших дополнительную очистку. После бортовой компьютер сравнивает показания двух зондов.
Если значения будут выравниваться, это укажет на выход из строя катализатора, о чем просигнализирует индикатор «Check engine».
Неисправности каталитического нейтрализатора
Все дело в том, что катализатор не вечен и со временем выходит из строя. Средний срок службы его составляет около 100 тыс. км. Если авто прошло такой километраж, и возникли проблемы с катализатором – это укажет на естественный износ. В таком случае слой нейтрализующих металлов с поверхности керамических сотов выгорел и выхлопные газы уже не очищаются.
Видео: Как пробить катализатор
Однако проблемы с катализатором могут возникнуть и значительно раньше. Виной тому может стать нарушенная работа системы зажигания или питания. По их вине может пройти засорение сотов сажей и другими продуктами горения, после чего работа катализатора нарушается.
Еще причиной поломки катализатора может стать некачественный бензин, особенно это проблема актуальна у нас. Часто для повышения октанового числа в бензин добавляется тетраметилсвинец. Октан он хоть и повышает, но в цилиндрах полностью не сгорает, а выходя из цилиндров – оседает на поверхности сотов блок-носителя, после чего катализатор перестает действовать.
Устранение проблем в работе
Решений проблем, возникших с каталитическим нейтрализатором – несколько. Первая и самая простая – замена катализатора на оригинальный. То есть, обращаетесь к официальным дилерам, они заказывают новый элемент, заменяют его и авто продолжает эксплуатироваться дальше. Но в этом есть одна значительная проблема – стоимость. Сейчас производители авто поступают по-хитрому – зачастую выпускной коллектор выполнен заодно с катализатором. А поскольку сам катализатор – не дешевый, а еще если и добавить коллектор, то и вовсе сумма за ремонт может выйти приличной.
Вторым способом решения проблемы является установка универсального катализатора. При этом восстановление работоспособности авто может обойтись значительно дешевле. Для авто подбирается определенная модель катализатора, подходящая по параметрам автомобиля. Далее неисправный катализатор вырезается из системы отвода выхлопных газов, на его место вваривается новый – универсальный.
Видео: Катализатор и пламегаситель, сравнение до и после, 0-100(120) км\ч Nissan Almera N16 QG15DE
И последний способ восстановления – замена катализатора на пламегаситель. Это самый «варварский» способ. Катализатор с выхлопной трубы вырезается, на его место вваривается пламегаситель, он же предварительный резонатор, который стабилизирует поток выхлопных газов при прохождении через него, но он никаких очистных работ не проводит. После производится перепрошивка бортового компьютера, и проблем с катализатором больше не возникает.
Что такое катализатор и как он работает?
На протяжении многих лет автопроизводители создают много усовершенствований в автомобильных двигателях и топливных системах, чтобы идти в ногу со временем и, безусловно, с законами, направленными на улучшение экологической ситуации на фоне выбросов автомобилей. Одно из кардинальных таких усовершенствований произошло в 1975 году с интересным устройством под названием катализатор. По сути работа катализатора заключается в преобразовании вредных веществ в менее вредные выбросы, прежде чем они покинут выхлопную систему автомобиля.
Так выглядит каталитический нейтрализатор
Катализатор — это удивительно простое устройство, однако, оно оказывает невероятно большое влияние на экологию нашей планеты. В этой статье Вы узнаете, какие загрязняющие вещества производятся двигателем, что такое катализатор и как катализатор работает, имея дело с каждым из этих загрязняющих веществ, чтобы помочь уменьшить выбросы из транспортных средств.
Какие загрязнения производит автомобиль?
В целях сокращения выбросов, современные автомобильные двигатели тщательно контролируют количество сгораемого в нём топлива. Они пытаются сохранить соотношение воздух-топливо очень близким к стехиометрической точке, которая является идеальным соотношением воздуха к топливу. Теоретически, при таком соотношении, всё топливо будет сожжено, используя весь кислород из поглощаемого воздуха. Для бензина стехиометрическая точка составляет около 14.7:1 — это означает, что на каждый литр бензина будет сожжено 14,7 граммов воздуха. Смесь топлива на самом деле колеблется от идеального соотношения совсем немного во время работы двигателя. Иногда смесь может быть бедной (соотношение воздух-топливо выше, чем 14,7), а в других случаях смесь может быть обогащённой (соотношение воздух-топливо ниже, чем 14,7).
Основными веществами в выхлопных газах двигателя автомобиля являются:
- Азот (N2) — воздух на 78 процентов состоит из газообразного азота, и большая часть этого азота проходит прямо через двигателя автомобиля и выходит, не вступив ни с чем в химическую реакцию.
- Углекислый газ (CO2) — это один из продуктов сгорания бензина.
- Водяной пар (h3O) — и ещё один продукт сгорания.
Эти выбросы, в основном, доброкачественные и не вредят атмосфере и экологии, хотя выбросы углекислого газа, как полагают, способствуют глобальному потеплению. Поскольку процесс сгорания никогда не совершенен, также в автомобильных двигателях производятся некоторые меньшие количества более вредных выбросов. Катализаторы предназначены как раз для снижения содержания именно этих выбросов, а, точнее, трёх самых объёмных и самых вредных:
- Окиси углерода (СО) — это ядовитый газ без цвета и запаха.
- Углеводородов (HC) и летучих органических соединений (ЛОС) — они являются одними из основных компонентов видимого нами дыма, который выходит при работе двигателя из выхлопной трубы автомобиля и производятся в основном из испарившегося, несгоревшего топлива.
- Оксидов азота (NO и NO2, вместе называемые NOx) — они являются также «соавторами» белого дыма, а ещё оксиды азота нередко провоцируют кислотные дожди, которые вызывают раздражение слизистых оболочек человека.
Кстати, знаете ли Вы, что, согласно исследованиям, даже новые модели двигателей газонокосилок выбрасывают в воздух в 93 раза больше образующих смог выхлопов, нежели новые модели автомобилей в случае аналогично производимой работы? Это не удивительно, ведь законов, регулирующих выхлопы газонокосилок, не существует ни в России, ни во многих других странах. Тем не менее, введение таких законов только в США (именно там проводилось исследование) может снизить выбросы на эквивалент до 800 000 автомобилей в день, и это впечатляющие цифры.
Как работает катализатор?
Понятие «катализатор» пришло к нам ещё из химии школьной программы, давайте вспомним — катализатор представляет собой вещество, которое вызывает ускорение химической реакции, и при этом сам катализатор в этой реакции не участвует. Точнее, катализаторы прямо участвуют в реакции и влияют на время её течения, но не являются ни реагентом, ни продуктом реакции, которую они катализируют. В человеческом организме ферменты являются по аналогии естественным катализатором, отвечающим за многие необходимые биохимические реакции.
Вообще, каталитический нейтрализатор состоит из двух различных типов катализаторов в своей работе: катализатора восстановления и катализатора окисления. Оба типа состоят из керамической структуры, покрытой металлическим каталитиком, обычно платиной, родием и/или палладием. Идея заключается в том, чтобы создать структуру, которая предоставляет максимальную площадь поверхности катализатора в потоке выхлопных газов, а также свести к минимуму требуемое количество катализатора, поскольку материалы для него чрезвычайно дороги. Некоторые из новейших преобразователей даже начали использовать золото, смешанное с более традиционными катализаторами. Золото, кстати, стоит даже дешевле, чем другие перечисленные материалы, но может привести к увеличению окисления.
Большинство современных автомобилей оснащено трёхкомпонентными каталитическими нейтрализаторами. Это означает, что они помогают уменьшить количество выбросов трёх самых вредных веществ, перечисленных немного выше в содержимом выхлопов.
Катализатор восстановления является первым этапом каталитического нейтрализатора. Он использует платину и родий, чтобы помочь уменьшить выбросы NOx (оксидов азота). Когда молекулы NO или NO2 вступают в контакт с катализатором, то последний расщепляет его на два компонента, отщепляя атом азота из молекулы и освобождая кислород в известной нам формуле O2. Атомы азота, в свою очередь, вступают в связь с другими атомами азота, которые также производятся катализатором, образуя химический элемент N2 (абсолютно безвредная молекула азота). В виде химической формулы это можно проиллюстрировать таким образом:
- 2NO => N2 + О2 или 2NO2 => N2 + 2*O2
Катализатор окисления является вторым этапом каталитического нейтрализатора. Он уменьшает количество несгоревших углеводородов и окиси углерода при окислении их в катализаторе за счёт платины и палладия. Этот катализатор способствует реакции СО и углеводородов с кислородом в выхлопных газах. Например:
Как работает катализатор? (кликните для просмотра)
Есть два основных типа конструкций, используемых в каталитических нейтрализаторах — сотовые и керамические. Большинство автомобилей сегодня используют сотовую структуру.
Третий этап работы катализатора заключается в системе управления, которая контролирует поток выхлопных газов и использует эту информацию для управления системой впрыска топлива в двигатель. Существует кислородный датчик, установленный выше по потоку до катализатора (то есть он ближе к двигателю, чем катализатор). Этот датчик сообщает бортовому компьютеру двигателя, сколько кислорода содержится в выхлопе. Компьютер может увеличить или уменьшить количество кислорода в выхлопных газах, регулируя соотношение воздух-топливо, поступаемое в цилиндры двигателя. Эта схема управления позволяет компьютеру двигателя убедиться, что двигатель работает на близкой к стехиометрической точке, а также что в выхлопе остаётся достаточное количество кислорода, чтобы окисление катализатора позволяло сжигать несгоревшие углеводороды и окись углерода.
Каталитический нейтрализатор делает большую работу по снижению загрязнения, но он всё ещё может быть значительно улучшен. Тем не менее, одним из самых больших его недостатков является то, что он работает только при достаточно высокой температуре. Когда Вы только начинаете прогревать свой автомобиль в холодную или тёплую погоду, каталитический нейтрализатор практически ничего не делает, чтобы уменьшить загрязнение в выхлопных газах.
Есть простое решение этой проблемы, которое состоит в перемещении катализатора ближе к двигателю. Это означает, что более горячие выхлопные газы достигнут катализатора, и он нагреется быстрее, но это также может уменьшить срок службы нейтрализатора, подвергая его воздействию очень высоких температур. Большинство автопроизводителей позиционируют каталитический преобразователь под передним пассажирским сиденьем — достаточно далеко от двигателя, чтобы поддерживать температуру такого уровня, который не будет вредить ему.
Расположение катализатора в автомобиле
Также хорошим способом для сокращения выбросов является предварительный нагрев каталитического нейтрализатора. Самый простой способ для достижения такой цели заключается в использовании электрических нагревателей сопротивления. К сожалению, 12-вольтовые электрические системы на большинстве автомобилей не обеспечивают достаточно энергии или мощности для нагрева каталитического нейтрализатора достаточно быстро. Большинство людей не будут ждать несколько минут, пока каталитический нейтрализатор нагреется. А вот гибридные автомобили, которые имеют в наличии большие высоковольтные блоки батарей, могут обеспечить достаточно энергии, чтобы разогреть каталитический нейтрализатор очень быстро.
Катализаторы в дизельном двигателе работают гораздо хуже в сокращении выбросов NOx. Одной из причин этого является то, что дизельные двигатели имеют более низкую рабочую температуру, чем бензиновые двигатели, и катализатор в целом в дизельном двигателе работает хуже, поскольку он меньше нагревается. Некоторые из ведущих экспертов экологических авто придумали новую систему, которая помогает бороться с этим. Они используют мочевину в решении этой проблемы: прежде чем оксиды азота уходят в катализатор, их принудительно испаряют и смешивают с выхлопом и затем создают химическую реакцию, которая приведёт к сокращению выбросов NOx. Мочевина, также известная как карбамид, представляет собой органическое соединение, изготовленное из углерода, азота, кислорода и водорода. Мочевина содержится в моче млекопитающих и земноводных. Мочевина реагирует с NOx, производя в результате реакции азот и водяной пар и утилизируя более 90 процентов оксидов азота в выхлопных газах.
Катализаторы для бензиновых двигателей
Окислительный катализатор

Рис. Окислительный катализатор
Окислительные катализаторы используются с двухтактными бензиновыми двигателями, дизельными двигателями и в качестве пусковых катализаторов. В них нейтрализуются только СО и углеводороды. Оксиды азота не нейтрализуются. В сочетании с сажевым фильтром они служат для окисления NO до NOx реагирующим в фильтре с сажей.
Будучи металлическими катализаторами, они устанавливаются в качестве предварительных или пусковых катализаторов в сочетании с катализатором тройного действия. В этом случае они находятся прямо на выпускном коллекторе или внутри него, при необходимости обогреваются и в фазе пуска и прогрева могут значительно снизить долю несгоревших углеводородов и оксида углерода. Возможно сочетание с системой впуска добавочного воздуха. Оксиды азота почти не образуются в фазе холодного пуска и поэтому их нейтрализация не требуется. Из-за монтажа рядом с двигателем предпочтительным является металлический катализатор.
Трехкомпонентный катализатор (тройного действия)

Рис. Катализатор тройного действия
Регулируемый катализатор тройного действия соответствует современному состоянию техники и постоянно совершенствуется. Высочайшей степени нейтрализации катализатор достигает для всех вредных компонентов в пределах лямбда-диапазона при коэффициенте избытка воздуха Л = 1 ± 0,005. У V-образных двигателей, как правило, работает по одному основному катализатору на каждом ряду цилиндров. Раньше использовались также системы без лямбда-регулирования в качестве нерегулируемого катализатора. При этом степень нейтрализации составляла лишь 50-60%.
При определенных условиях испытаний европейского цикла (NEDC) двигатель объемом 2 литра, с расходом топлива около 9 л на 100 км и соотношением «топливо-воздух» X = 1 выбрасывает на один километр следующие объемы вредных веществ:
- СН — около 1,20 г
- СО — около 6,70 г
- NOx — около 3,01 г
- СO2 — около 202 г
Это количество вредных веществ катализатор должен превратить в неядовитые компоненты. Чтобы соблюсти требования нормы Евро-3 (СО = 1,5 г/км, СН = 0,2 г/км и NOx = 0,15 г/км), нужно было достичь степени нейтрализации не менее 85% по СО и более 90% по СН и NOx. С появлением норм Евро-4 и Евро-5 требуется еще более высокая степень нейтрализации.
Пределы использования катализаторов тройного действия возникают при отклонении от стехиометрического состава смеси во время работы двигателя (двигатели, работающие на бедной смеси). В этом случае восстановление оксида азота стремится к нулю.
Требования к новым концепциям катализаторов
Для соблюдения новых норм токсичности ОГ были разработаны новые концепции с особенно эффективной нейтрализацией СО и СН при холодном пуске и прогреве. Как показали испытания, в течение первых трех минут после холодного пуска выбрасывается наибольшее количество СО и СН. Катализатор не успевает прогреться до температуры Light-off, и нейтрализация СО и СН почти не происходит. Новые концепции предлагают, к примеру, расположение катализатора ближе к двигателю или комбинации из предварительного и основного катализаторов. Все больше применяется подача добавочного воздуха. Впуск добавочного воздуха перед катализатором приводит к дожигу (дополнительному окислению СО и СН в СO2 и Н2О в катализаторе). Кроме того, катализатор нагревается в результате химических реакций, что становится особенно заметно в фазе прогрева двигателя с быстрым достижением рабочей температуры.
Самый большой потенциал улучшения катализаторов кроется в значительном сокращении времени на достижение точки начала температурного скачка. Не позднее, чем через 15 секунд после холодного пуска катализатор должен быть готов к работе. При этом важную роль играют также пассивные (например, изоляция выпускного коллектора) и активные системы (например, электрообогрев или система впуска вторичного воздуха). На рисунке изображена сложная система очистки ОГ с различными активными и пассивными компонентами. Несколько специальных катализаторов в одном выпускном тракте — это уже реальность.

Рис. Комплексная система очистки ОГ [источник: Bosch]
На пороге запуска в серийное производства находятся катализаторы, способные восстанавливать оксиды азота при избытке воздуха. Их также называют DeNOx — катализаторами и работают они с покрытиями из оксида ванадия, оксида вольфрама и оксида титана или с иридием. В настоящее время автопроизводители и изготовители систем занимаются апробированием различных систем для минимизации вредных веществ — как для соблюдения перспективных норм токсичности ОГ, так и для решения проблем при внедрении новых концепций двигателей (например, непосредственного впрыска бензина). С появлением бензиновых двигателей с непосредственным впрыском и двигателей, работающих на бедных смесях, стали необходимыми системы для снижения выбросов оксида азота при сгорании бедных смесей. Перспективные нормы токсичности ОГ не учитывают технических проблем технологий впрыска и сжигания. В таблице приведен обзор используемых на сегодня вариантов. Необходимо обратить внимание, что эти системы могут использоваться и для бензиновых двигателей, работающих на бедных смесях, и для дизельных двигателей.

Таблица. Сравнение применяющихся технологий DeNOx для дизельных двигателей и бензиновых двигателей с непосредственным впрыском
Катализаторы, расположенные рядом с двигателем
Системы, где катализатор, расположен рядом с двигателем, называют также Close Coupled Catalyst (ССС). Преимущество этих систем состоит в предотвращении потерь тепла за счет размещения непосредственно на выпускном коллекторе. Время до достижения точки Light-off составляет всего несколько секунд. Проблемой при таком расположении являются высокая температура ОГ — до 1050°С при полной нагрузке и отрицательное влияние на мощность и крутящий момент двигателя. Требуется очень точная аэродинамическая оптимизация и адаптация системы «коллектор — катализатор». Снижение выбросов СО и СН составляет около 70%. Схема расположения рядом с двигателем пускового и основного катализаторов показана на рисунке.

Рис. Сочетание пускового и основного катализаторов
В качестве пускового катализатора используется окислительный катализатор с металлическим носителем, устанавливаемый очень близко к двигателю в выпускном тракте. При таком расположении пусковой катализатор очень быстро нагревается и сразу после пуска обеспечивает очень высокую степень нейтрализации СО и СН. В результате экзотермических химических реакций выделяется дополнительное тепло, забираемое отработавшими газами и обеспечивающее более быстрый нагрев основного катализатора. Система дополняется выпускным коллектором из листовой стали, изолированным воздушными зазорами.
Особым вариантом конструкции является расположенный рядом с двигателем основной катализатор без дополнительного пускового катализатора. Благодаря расположению рядом с двигателем основной катализатор очень быстро достигает точки начала температурного скачка. За счет более высокой температуры быстрее протекают химические реакции. Общий объем катализатора можно уменьшить. Проблемой при этом расположении является создание достаточно термостойкого слоя, предотвращающего раннее термическое старение и, следовательно, сокращение срока службы катализатора.
Байпасная система

Рис. Байпасная система
Байпасные системы бывают разных вариантов. Такие системы используются в основном для выравнивания в катализаторах слишком высоких или слишком низких температур ОГ при различных рабочих режимах двигателя. У этой системы в фазе пуска отработавшие газы по короткому и прямому трубопроводу направляются из выпускного коллектора в катализатор. В фазе прогрева с помощью заслонки обеспечивается прямое поступление ОГ в катализатор. Небольшое сечение труб и большая скорость потока газов предотвращают возникновение тепловых потерь в выпускном тракте. Задний катализатор NOx быстро нагревается до рабочей температуры. При высоких температурах ОГ заслонка открывается, и газы по обеим выпускным трубам устремляются в катализатор. Проходя более длинный путь, ОГ охлаждаются и не могут термически повредить катализатор. Эту систему, с вакуумным управлением, использует Mercedes в двигателях CGI. Датчик температуры определяет температуру ОГ и сообщает ее блоку управления, активирующему заслонку ОГ.
Катализатор с электрообогревом

Рис. Катализатор с электрообогревом
Используя металлический блок в качестве нагревательной спирали, можно быстро и непосредственно нагреть катализатор. Нагревом и регулированием температуры управляет электронный блок двигателя. Проблемой в этой системе является большая техническая сложность и вытекающая отсюда стоимость системы. Необходимо использовать аккумуляторные батареи большой емкости, что увеличивает массу автомобиля и занимаемое пространство. Для небольших автомобилей эта концепция не подходит. Мощность потребляемая нагревом составляет 1,2-1,5 кВт. Катализаторы с электрообогревом впервые были применены в BMW Alpina В12 и BMW 7-й серии. Катализатор с электрообогревом (E-Kat) комбинируется с улавливателем углеводородов (CH-Adsorber). Управление обогреваемым катализатором осуществляется по CAN-шине. Увеличение мощности нагрева и совершенствование бортовых сетей позволят добиться дополнительных возможностей.
Для обеспечения высокой потребляемой мощности катализаторов с электрообогревом без перегрузки бортовой сети требуется дополнительная аккумуляторная батарея. Мощный генератор с водяным охлаждением обеспечивает работу бортовой сети даже при неблагоприятных условиях. Здесь требуются также интеллектуальное управление бортовой сетью и электронная система управления АКБ.

Рис. Принципиальная схема катализатора с электрообогревом
На стадии апробирования находятся варианты обогреваемых пусковых катализаторов с горелками, сжигающими топливо из бака и обогревающими катализатор. Проблемой является регулирование температуры, так как с одной стороны для нагрева требуется высокая температура, а с другой — слишком высокие температуры и локальные температурные пики могут привести к быстрому старению или термическому разрушению катализатора.
Накопительный катализатор — SCR-катализатор
SCR расшифровывается как Selective Catalytic Reduction (селективное каталитическое восстановление). Эти системы особенно подходят для двигателей, работающих на бедных смесях. В диапазоне выше Л = 1 в качестве восстановителей для оксидов азота можно использовать только углеводороды или аммиак. В накопительном катализаторе, также называемом NOx-адсорбером, оксиды азота NOx удерживаются в режиме работы двигателя на бедных смесях до тех пор, пока двигателю не будет дана команда на образование богатой топливовоздушной смеси. В качестве накопительных компонентов для NOx используются щелочные и щелочноземельные соединения. Во время накопления оксид азота каталитически окисляется. Возникающий при этом диоксид азота NO2 вступает в реакцию с оксидом металла, образуя нитрат M-NO3. При кратковременном обогащении смеси содержащиеся в выхлопе восстановители СН и СО расщепляют нитраты. N0 отдается в богатую оксидом углерода среду, и под воздействием родия образуются СO2 и N2 При этом различают четыре этапа превращения.
1. Окисление —» 2. Поглощение —» 3. Расщепление —» 4. Восстановление
Недостатками этой технологии являются высокая чувствительность к сере и снижение степени нейтрализации в диапазоне высоких температур. В режиме бедной смеси SO2 в накопительном катализаторе окисляется до SO3. Оксид серы, как и NO, реагирует с аккумулирующим оксидом, образуя агрессивные сульфаты. Они остаются в накопителе и в фазе обогащения, тем самым уменьшая его емкость и производительность. Уже после небольшого пробега в катализаторе начинается отравление серой.
Снижается стойкость к старению, сокращается срок службы. Необходимое обогащение смеси в фазе восстановления приводит к увеличению расхода на 1,5-2%. Таким образом, срок службы накопительного катализатора в основном зависит от качества используемого топлива (в плане содержания серы). Вот причина, по которой выбросы NOK у японских двигателей GDI в Японии уже достаточно давно удалось снизить с помощью накопительного катализатора. В Европе это решение долгое время было невозможным из-за высокого содержания серы в топливе. Так содержание серы до 500 промилле (ррт) существенно снижало степень нейтрализации и срок службы катализаторов. Ситуация изменилась с выходом директивы 98/70/EG о качестве топлива, вступившей в силу 1 января 2000 г.
Используемые в грузовиках SCR-катализаторы с добавками на основе мочевины можно использовать и в легковых автомобилях. Не исключено, что с вводом Евро-5 эта технология будет использоваться и в более крупных бензиновых двигателях с непосредственным впрыском или в дизельных двигателях легковых автомобилей. Первые системы были представлены на автосалоне IAA 2005 концерном Mercedes-Benz в гибридных автомобилях для американского рынка.
Непрерывно работающие катализаторы восстановления

Рис. SCR-катализатор непрерывного действия
Концерн Mitsubishi в своих двигателях GDI использовала непрерывно работающий катализатор восстановления с иридиевым покрытием. Такой катализатор обеспечивает небольшую степень нейтрализации, но менее чувствителен к содержанию серы в топливе. Принцип действия селективного каталитического восстановления прост. NOx восстанавливается в катализаторе за счет избытка СН до N2, Н2O и СО2. Выбросы NOx можно уменьшить на 60%. Для этого катализатор должен работать в диапазоне температур 300-600°С. Проблема состоит в выбросах при холодном пуске.
Если перед обычным накопительным катализатором можно установить традиционный катализатор, то в случае с иридиевым катализатором это невозможно. Этому катализатору для восстановления оксидов азота необходимы содержащиеся в выхлопе углеводороды. По этой причине установка катализатора тройного действия перед иридиевым катализатором невозможна. Степень нейтрализации в иридиевом катализаторе заметно снизилась бы. Если поменять катализаторы местами, то температура ОГ на входе катализатора тройного действия окажется слишком мала для обеспечения удовлетворительной степени нейтрализации. Несмотря на это, концерн Mitsubishi применил эту концепцию катализатора тройного действия перед иридиевым катализатором в европейских двигателях GDI. Для соблюдения европейских предельных значений для ОГ необходимо было дополнительно изменить картину впрыска и сгорания и адаптировать к европейским условиям испытаний и эксплуатации.
Прерывисто работающие катализаторы восстановления
Концерн Volkswagen для двигателей FSI с концепцией бедной смеси использует прерывисто работающий катализатор восстановления с платиной и родием с примесью щелочного соединения, карбоната бария (BaCO3). Peugeot и Сitroen тоже используют эту технологию в двигателях HPI.

Рис. SCR-катализатор прерывистого действия
В этой системе NO окисляется кислородом до NO, на слое платины катализатора и аккумулируется в накопителе. Накопление оксидов азота происходит не постоянно. Через определенные интервалы требуется восстановление. Для этого смесь каждые 60 секунд обогащается в течение 2 секунд, и накопленный NOx восстанавливается под воздействием родия.
Датчик NOx на выходе катализатора служит для контроля за накапливанием оксидов азота. Катализатор оптимально работает в диапазоне от 250°С до 500°С. Чтобы выдержать этот температурный диапазон даже при высоких нагрузках, требуется охлаждение отработавших газов. Для обеспечения хорошего теплоотвода система выпуска ОГ между катализаторами делается трехпоточной. Кроме того, на пусковой катализатор ОГ подается встречный воздушный поток.
Проблемой в этой системе является также ухудшение способности накапливать NOx из-за сульфатизации накапливаемого материала. Сера выгоняется лишь при температурах выше 650°С.Для удаления серы используются различные стратегии: естественное удаление серы при высокой температуре ОГ, управляемое электроникой двигателя переключение с бедной смеси на богатую и, наоборот, в зависимости от сигналов датчика NCK Постоянное изменение насыщения смеси называют лямбда-скачками. При удалении серы особое значение придается предотвращению образования сероводорода (h3S). Содержащее мало серы или лучше вовсе не содержащее серы топливо совершенно необходимо для высокого КПД и длительного срока службы системы. В настоящее время повсеместное использование невозможно.

Рис. Принцип удаления серы в накопительном катализаторе
На рисунке показаны процессы в накопительном катализаторе при бедной смеси в фазе аккумулирования NOx (слева) и при богатой смеси в фазе восстановления (справа).
Автомобильный катализатор — что это такое? Описание принципов работы, а так же видеоинструкция по замене.
Сегодня практически все автомобильные производители вовлечены в битву за сохранение окружающей среды. Делается это различными методами. К примеру, Европейский Союз ввёл норму по выхлопным газам, если автомобиль превышает эту норму, он не может реализовываться на территории ЕС.
Катализаторы — это специальные узлы, которые находятся между двигателем внутреннего сгорания и глушителем автомобиля. О принципах их работы и возможных неполадках пойдёт речь в нижеприведённой статье.
Как устроен катализатор?
Суть заключается в том, что отработанные газы из ДВС извлекаются из него. Однако, если их сразу выбрасывать в окружающую среду, то вред будет весьма значительным. Внутри катализатора происходит химическая реакция, которая в несколько десятков раз снижает вредность газов.
Далее происходит их фильтрация, и только после этого выхлопные газы попадают в глушитель. Специалисты настоятельно рекомендуют постоянно проверять защищённость катализатора.
Пока автомобиль «холодный», катализатор не работает. С его нагреванием, раскаляется и сам катализатор. При длительной работе он может раскаляться докрасна.
Возможные неполадки у катализатора
Отметим, что полное название означенного технического узла следующее — каталитический нейтрализатор. Поэтому если Вы ищете эту деталь на замену, и Вам продавец говорит, что катализатор нет, есть только нейтрализатор, будьте уверены в том, что Вы и продавец имеете в виду одно и тоже.
Катализатор может находиться в трёх состояниях:
- рабочий;
- частичное функционирование;
- сломан.
Нужно подчеркнуть, что катализатор достаточно сложно починить. По стоимости это будет сопоставимо с новой аналогичной деталью. Безответственные водители попросту снимают катализатор.
Автомобиль от этого не станет работать хуже, скорее даже наоборот. Но при этом в окружающую среду будет постоянно выбрасываться не только парниковые газы (CO2), но и токсичные вещества (канцерогены).
Глупо указывать на безрезультатную борьбу «зелёных» организаций с глобальным потеплением, если сам постоянно вносишь вклад в его увеличение. Если автомобиль на гарантии, катализатор заменят абсолютно бесплатно. Делается это в течение получаса.
Смотрите также:
На видео будет продемонстрирована замена катализатора на Kia Ceed:
Катализ — Википедия
Ката́лиз (греч. κατάλυσις от καταλύειν «разрушение») — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который, согласно теории промежуточных соединений, многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.[1]
Термин «катализ» был введён в 1835 году шведским учёным Йёнсом Якобом Берцелиусом.
Катализа́ция (явление катализа) распространена в природе (большинство процессов, происходящих в живых организмах, являются каталитическими) и широко используется в технике (в нефтепереработке и нефтехимии, в производстве серной кислоты, аммиака, азотной кислоты и др.: большая часть всех промышленных реакций — каталитические).
Случай, когда катализатором является один из продуктов реакции или её исходных веществ, называют автокатализом.
Катализатор изменяет механизм реакции на энергетически более выгодный, то есть снижает энергию активации. Катализатор образует с молекулой одного из реагентов промежуточное соединение, в котором ослаблены химические связи. Это облегчает его реакцию со вторым реагентом. Важно отметить, что катализаторы ускоряют обратимые реакции как в прямом, так и в обратном направлениях. Поэтому они не смещают химическое равновесие[2].
По влиянию на скорость реакции катализ многие источники делят на положительный (скорость реакции растет) и отрицательный (скорость реакции падает). В случае ингибирования цепных реакций, ингибитор расходуется в процессе реакции, поэтому данный случай нельзя считать отрицательным катализом.
Катализ бывает гомогенным и гетерогенным (контактным). В гомогенном катализе катализатор состоит в той же фазе, что и реактивы реакции, в то время как гетерогенные катализаторы отличаются фазой.
Гомогенный катализ[править | править код]
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + I → H2О + IO H2О2 + IO → H2О + О2 + IПри гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
- Диффузия реагирующих веществ к поверхности твердого вещества
- Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем их хемосорбция
- Химическая реакция между реагирующими молекулами
- Десорбция продуктов с поверхности катализатора
- Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
Течение реакции именно на поверхности катализатора можно продемонстрировать на опыте, в котором пластинку из платины нагревают в пламени газовой горелки, затем пламя тушат и пускают на пластинку струю газа из горелки, при этом пластинка снова раскаляется докрасна — окисление метана происходит на поверхности металла[3].
 Металлическая платина (показана стрелками), стабилизированная на носителе — оксиде алюминия
Металлическая платина (показана стрелками), стабилизированная на носителе — оксиде алюминияНоситель катализатора, иначе подложка (катализатора) (англ. carrier или support) — инертный или малоактивный материал, служащий для стабилизации на его поверхности частиц активной каталитической фазы.
Роль носителя в гетерогенном катализе состоит в предотвращении агломерации или спекания активного компонента, что позволяет поддерживать высокую площадь контакта активного вещества (см. активная каталитическая фаза) и реагентов. Количество носителя, как правило, гораздо больше количества нанесенного на него активного компонента. Основными требованиями к носителям являются большая площадь поверхности и пористость, термическая стабильность, химическая инертность, высокая механическая прочность. В ряде случаев носитель влияет на свойства активной фазы (эффект «сильного взаимодействия металл-носитель»). В качестве носителей применяют как природные (глины, пемза, диатомит, асбест и др.), так и синтетические материалы (активные угли, силикагель, алюмосиликаты, оксиды алюминия, магния, циркония и др.)[4].
Химия катализа изучает вещества, изменяющие скорость химических реакций. Вещества, замедляющие реакции, называются ингибиторами. Ферменты — это биологические катализаторы. Катализатор не находится в стехиометрических отношениях с продуктами и регенерируется после каждого цикла превращения реагентов в продукты. Несмотря на появление новых способов активации молекул (плазмохимия, радиационное и лазерное воздействия и другие), катализ − основа химических производств (относительная доля каталитических процессов составляет 80-90 %).
Реакция, накормившая человечество (решение проблемы связанного азота) — цикл Габера-Боша. Аммиак получают с катализатором — пористым железом. Протекает при Р = 30 МПа и Т = 420—500 °C
3Н2 + N2 = 2NH3
Водород для синтеза NH3 получают путём двух последовательных каталитических процессов: конверсии СН4(СН4 + Н2О → СО + 3Н2) на Ni−катализаторах и конверсии образующегося оксида углерода (СО + Н2О → СО2 + Н2). Для достижения высоких степеней превращения последнюю реакцию осуществляют в две стадии: высокотемпературная (315—480 °C) — на Fe−Cr−оксидных катализаторах и низкотемпературная (200—350 °C) — на Cu−Zn−оксидных катализаторах. Из аммиака получают азотную кислоту и другие соединения азота — от лекарств и удобрений до взрывчатых веществ.
Различают катализы »гомогенный, гетерогенный, межфазный, мицеллярный, ферментативный.
Энергия активации E каталитических реакций значительно меньше, чем для той же реакций в отсутствие катализатора. Например, для некаталитического разложения NH3 на N2 + Н2E ~ 320 кДж/моль, для того же разложения в присутствии платины Е ~ 150 кДж/моль. Благодаря снижению E обеспечивается ускорение каталитических реакций по сравнению с некаталитическими.
Применение катализа в промышленности[править | править код]
Гидрирование[править | править код]
Большое число каталитических реакций связано с активацией атома водорода и какой-либо другой молекулы, приводящей к их химическому взаимодействию. Этот процесс называется гидрированием и лежит в основе многих этапов переработки нефти и получения жидкого топлива из угля (процесс Бергиуса). Производство авиационного бензина и моторного топлива из угля было развито в Германии во время Второй мировой войны, поскольку в этой стране нет нефтяных месторождений. Процесс Бергиуса заключается в непосредственном присоединении водорода к углю. Уголь нагревают под давлением в присутствии водорода и получают жидкий продукт, который затем перерабатывают в авиационный бензин и моторное топливо. В качестве катализатора используют оксид железа, а также катализаторы на основе олова и молибдена. Во время войны на 12 заводах Германии с помощью процесса Бергиуса получали примерно 1400 т жидкого топлива в сутки. Другой процесс, Фишера — Тропша, состоит из двух стадий. Вначале уголь газифицируют, то есть проводят реакцию его с водяным паром и кислородом и получают смесь водорода и оксидов углерода. Эту смесь превращают в жидкое топливо с помощью катализаторов, содержащих железо или кобальт. С окончанием войны производство синтетического топлива из угля в Германии было прекращено. В результате повышения цен на нефть, последовавшего за нефтяным эмбарго в 1973—1974, были предприняты энергичные усилия по разработке экономически выгодного способа получения бензина из угля. Так, прямое ожижение угля можно проводить более эффективно, используя двухстадийный процесс, в котором сначала уголь контактирует с алюмокобальтомолибденовым катализатором при относительно низкой, а затем при более высокой температуре. Стоимость такого синтетического бензина выше, чем получаемого из нефти.
Кислотный катализ[править | править код]
Каталитическая активность большого класса катализаторов обусловливается их кислотными свойствами. Согласно Й. Брёнстеду и Т. Лоури, кислота — это соединение, способное отдавать протон. Сильные кислоты легко отдают свои протоны основаниям. Концепция кислотности получила дальнейшее развитие в работах Г. Льюиса, который дал определение кислоты как вещества, способного принимать электронную пару от вещества-донора с образованием ковалентной связи за счет обобществления этой электронной пары. Эти идеи вместе с представлениями о реакциях с образованием карбений-ионов помогли понять механизм разнообразных каталитических реакций, особенно тех, в которых участвуют углеводороды.
Силу кислоты можно определить с помощью набора оснований, изменяющих цвет при присоединении протона. Оказывается, некоторые промышленно важные катализаторы ведут себя как очень сильные кислоты. К ним относится катализатор процесса Фриделя — Крафтса, такой, как HCl-AlCl2O3 (или HAlCl4), и алюмосиликаты. Сила кислоты — это очень важная характеристика, поскольку от неё зависит скорость протонирования — ключевого этапа процесса кислотного катализа.
Активность таких катализаторов, как алюмосиликаты, применяющихся при крекинге нефти, определяется присутствием на их поверхности кислот Брёнстеда и Льюиса. Их структура аналогична структуре кремнезема (диоксида кремния), в котором часть атомов Si4+ замещена атомами Al3+. Лишний отрицательный заряд, возникающий при этом, может быть нейтрализован соответствующими катионами.
Активность кислотных катализаторов обусловливается их способностью реагировать с углеводородами с образованием в качестве промежуточного продукта карбений-иона. Алкилкарбений-ионы содержат положительно заряженный углеродный атом, связанный с тремя алкильными группами и/или атомами водорода. Они играют важную роль как промежуточные продукты, образующиеся во многих реакциях с участием органических соединений. Механизм действия кислотных катализаторов можно проиллюстрировать на примере реакции изомеризации н-бутана в изобутан в присутствии HCl-AlCl3 или Pt-Cl-Al2O3. Сначала малое количество олефина С4Н8 присоединяет положительно заряженный ион водорода кислотного катализатора с образованием третичного карбений-иона. Затем отрицательно заряженный гидрид-ион Н— отщепляется от н-бутана с образованием изобутана и вторичного бутилкарбений-иона. Последний в результате перегруппировки превращается в третичный карбений-ион. Эта цепочка может продолжаться с отщеплением гидрид-иона от следующей молекулы н-бутана и т. д.
Существенно, что третичные карбений-ионы более стабильны, чем первичные или вторичные. Вследствие этого на поверхности катализатора присутствуют в основном именно они, а потому основным продуктом изомеризации бутана является изобутан.
Кислотные катализаторы широко применяются при переработке нефти — крекинге, алкилировании, полимеризации и изомеризации углеводородов. Установлен механизм действия карбений-ионов, играющих роль катализаторов в этих процессах. При этом они участвуют в целом ряде реакций, включая образование малых молекул путём расщепления больших, соединение молекул (олефина с олефином или олефина с изопарафином), структурную перегруппировку путём изомеризации, образование парафинов и ароматических углеводородов путём переноса водорода.
Одно из последних применений кислотного катализа в промышленности — получение этилированных топлив присоединением спиртов к изобутилену или изоамилену. Добавление кислородсодержащих соединений в бензин уменьшает концентрацию оксида углерода в выхлопных газах. Метил-трет-бутиловый эфир (МТБЭ) с октановым числом смешения 109 тоже позволяет получить высокооктановое топливо, необходимое для работы автомобильного двигателя с высокой степенью сжатия, не прибегая к введению в бензин тетраэтилсвинца. Организовано также производство топлив с октановыми числами 102 и 111.
Гидрирование растительного масла[править | править код]
Одна из важнейших в практическом отношении реакций гидрирования — неполное гидрирование растительных масел до маргарина, кулинарного жира и других пищевых продуктов. Растительные масла получают из соевых бобов, семян хлопчатника и других культур. В их состав входят эфиры, а именно триглицериды жирных кислот с разной степенью ненасыщенности. Олеиновая кислота СН3(СН2)7СН=СН(СН2)7СООН имеет одну двойную связь С=С, линолевая кислота — две и линоленовая — три. Присоединение водорода с разрывом этой связи предотвращает окисление масел (прогоркание). При этом повышается их температура плавления. Твердость большинства получаемых продуктов зависит от степени гидрирования. Гидрирование проводят в присутствии мелкодисперсного порошка никеля, нанесенного на подложку, или никелевого катализатора Ренея в атмосфере водорода высокой степени очистки.
Дегидрирование[править | править код]
Дегидрирование — это тоже важная в промышленном отношении каталитическая реакция, хотя масштабы её применения несравнимо меньше. С её помощью получают, например, стирол — важный мономер. Для этого дегидрируют этилбензол в присутствии катализатора, содержащего оксид железа; протеканию реакции способствуют также калий и какой-нибудь структурный стабилизатор. В промышленных масштабах осуществляют дегидрирование пропана, бутана и других алканов. Дегидрированием бутана в присутствии алюмохромового катализатора получают бутены и бутадиен.
Аммиак[править | править код]
Один из самых простых с химической точки зрения процессов гидрирования — синтез аммиака из водорода и азота. Азот весьма инертное вещество. Для разрыва связи N-N в его молекуле необходима энергия порядка 200 ккал/моль. Однако азот связывается с поверхностью железного катализатора в атомарном состоянии, и для этого нужно всего 20 ккал/моль. Водород связывается с железом ещё более охотно.
Основный катализ[править | править код]
Активность катализаторов обуславливается их основными свойствами. Давним и хорошо известным примером таких катализаторов является гидроксид натрия, применяющийся для гидролиза или омыления жиров при получении мыла, а один из последних примеров — катализаторы, используемые при производстве полиуретановых пластиков и пенопластов. Уретан образуется при взаимодействии спирта с изоцианатом, а ускоряется эта реакция в присутствии оснóвных аминов. В ходе реакции происходит присоединение основания к атому углерода в молекуле изоцианата, в результате чего на атоме азота появляется отрицательный заряд и его активность по отношению к спирту повышается. Особенно эффективным катализатором является триэтилендиамин. Полиуретановые пластики получают при взаимодействии диизоцианатов с полиолами (полиспиртами). Когда изоцианат реагирует с водой, ранее образовавшийся уретан разлагается с выделением CO2. При взаимодействии смеси полиспиртов и воды с диизоцианатами образующийся пенополиуретан вспенивается газообразным CO2.
Катализаторы двойного действия[править | править код]
Эти катализаторы ускоряют реакции двух типов и дают лучшие результаты, чем при пропускании реагентов последовательно через два реактора, каждый из которых содержит только один тип катализатора. Это связано с тем, что активные центры катализатора двойного действия находятся очень близко друг к другу, и промежуточный продукт, образующийся на одном из них, тут же превращается в конечный продукт на другом. Хороший результат дает объединение катализатора, активирующего водород, с катализатором, способствующим изомеризации углеводородов. Активацию водорода осуществляют некоторые металлы, а изомеризацию углеводородов — кислоты. Эффективным катализатором двойного действия, который применяется при переработке нефти для превращения нафты в бензин, является мелкодисперсная платина, нанесенная на кислый глинозем. Конверсия таких составляющих нафты, как метилциклопентан метилциклопентан (МЦП), в бензол повышает октановое число бензина. Сначала МЦП дегидрируется на платиновой части катализатора в олефин с тем же углеродным остовом; затем олефин переходит на кислотную часть катализатора, где изомеризуется до циклогексена. Последний переходит на платиновую часть и дегидрируется до бензола и водорода. Катализаторы двойного действия существенно ускоряют риформинг нефти. Их используют для изомеризации нормальных парафинов в изопарафины. Последние, кипящие при тех же температурах, что и бензиновые фракции, ценны тем, что обладают более высоким октановым числом по сравнению с неразветвлёнными углеводородами. Кроме того, превращение н-бутана в изобутан сопровождается дегидрированием, способствуя получению МТБЭ.
Стереоспецифическая полимеризация[править | править код]
Важной вехой в истории катализа явилось открытие каталитической полимеризации-олефинов с образованием стереорегулярных полимеров. Катализаторы стереоспецифической полимеризации были открыты К.Циглером, когда он пытался объяснить необычные свойства полученных им полимеров. Другой химик, Дж. Натта, предположил, что уникальность полимеров Циглера определяется их стереорегулярностью. Эксперименты по дифракции рентгеновских лучей показали, что полимеры, полученные из пропилена в присутствии катализаторов Циглера, высококристалличны и действительно имеют стереорегулярную структуру. Для описания таких упорядоченных структур Натта ввел термины «изотактический» и «синдиотактический». В том случае, когда упорядоченность отсутствует, используется термин «атактический».
Стереоспецифическая реакция протекает на поверхности твердых катализаторов, содержащих переходные металлы групп IVA-VIII (такие, как Ti, V, Cr, Zr), находящиеся в неполностью окисленном состоянии, и какое-либо соединение, содержащее углерод или водород, который связан с металлом из групп I—III. Классическим примером такого катализатора является осадок, образующийся при взаимодействии TiCl4 и Al(C2H5)3 в гептане, где титан восстановлен до трехвалентного состояния. Эта исключительно активная система катализирует полимеризацию пропилена при обычных температуре и давлении.
Каталитическое окисление[править | править код]
Применение катализаторов для управления химизмом процессов окисления имеет большое научное и практическое значение. В некоторых случаях окисление должно быть полным, например при нейтрализации СО и углеводородных загрязнений в выхлопных газах автомобилей. Однако чаще нужно, чтобы окисление было неполным, например во многих широко применяемых в промышленности процессах превращения углеводородов в ценные промежуточные продукты, содержащие такие функциональные группы, как -СНО, -СООН, -С-СО, -СN. При этом применяются как гомогенные, так и гетерогенные катализаторы. Примером гомогенного катализатора является комплекс переходного металла, который используется для окисления пара-ксилола до терефталевой кислоты, эфиры которой служат основой производства полиэфирных волокон.
Получение этилена путём дегидродимеризации метана[править | править код]
Синтез этилена посредством дегидродимеризации позволяет превращать природный газ в более легко транспортируемые углеводороды. Реакцию 2CH4 + 2O2 → C2H4 + 2H2O проводят при 850 °С с использованием различных катализаторов; наилучшие результаты получены с катализатором Li-MgO. Предположительно реакция протекает через образование метильного радикала путём отщепления атома водорода от молекулы метана. Отщепление осуществляется неполностью восстановленным кислородом, например О2−
2. Метильные радикалы в газовой фазе рекомбинируют с образованием молекулы этана и в ходе последующего дегидрирования превращаются в этилен. Ещё один пример неполного окисления — превращение метанола в формальдегид в присутствии серебряного или железомолибденового катализатора.
Катализаторы гетерогенного окисления[править | править код]
Эти катализаторы обычно являются сложными твердыми оксидами. Каталитическое окисление проходит в два этапа. Сначала кислород оксида захватывается адсорбированной на поверхности оксида молекулой углеводорода. Углеводород при этом окисляется, а оксид восстанавливается. Восстановленный оксид взаимодействует с кислородом и возвращается в исходное состояние. Используя ванадиевый катализатор, неполным окислением нафталина или бутана получают фталевый ангидрид.
- Боресков Г. К. Катализ. Вопросы теории и практики. — Новосибирск, 1987.
- Гейтс Б. Химия каталитических процессов / Б. Гейтс, Дж. Кетцир, Г. Шуйт. — М.: Мир, 1981. — 551 с.
- Журнал «Кинетика и катализ».
- Колесников И. М. Катализ и производство катализаторов. — М.: Техника, 2004. — 399 с.
- Яблонский Г. С., Быков В. И., Горбань А. Н. Кинетические модели каталитических реакций. — Новосибирск: Наука (Сиб. отделение), 1983. — 255 c.
Состав автомобильных катализаторов — Katalizator1
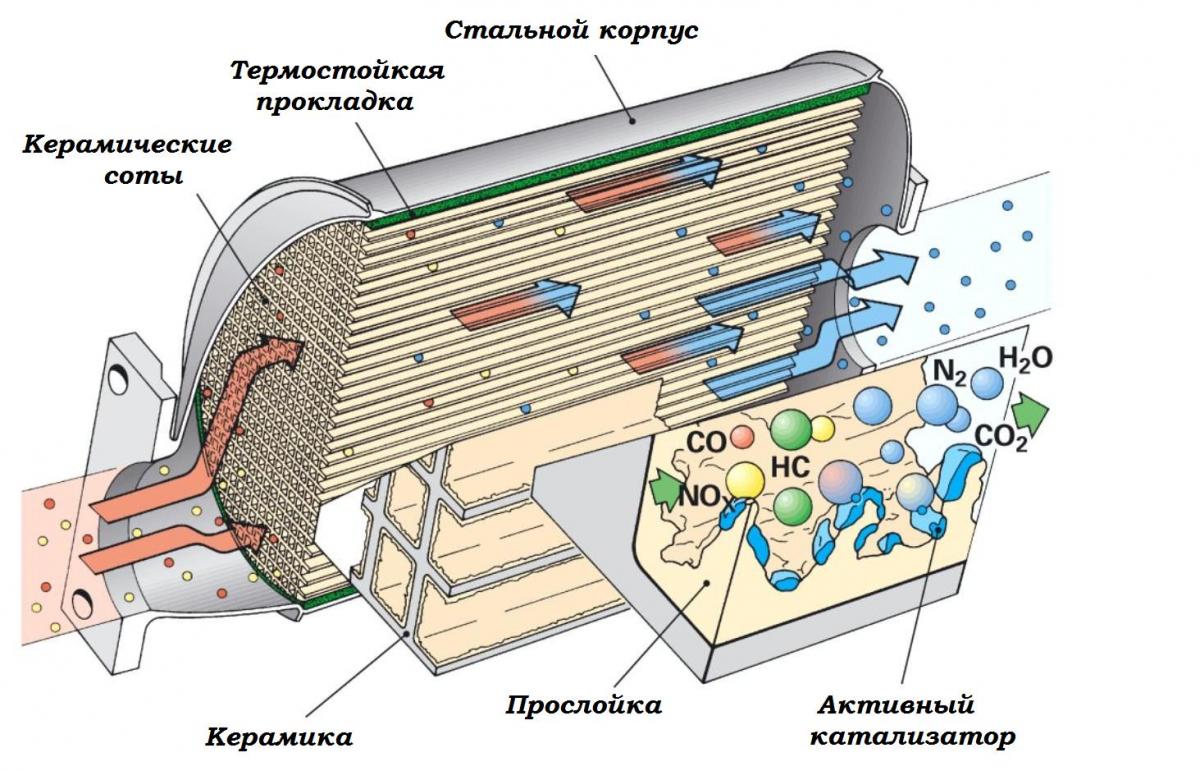
Каталитические нейтрализаторы – неотъемлемая часть выхлопной системы транспортного средства, необходимая для очистки выхлопов от токсичных компонентов. Фильтрация газов происходит за счет напыления из драгоценных металлов. Благодаря дорогостоящему составу автомобильные катализаторы представляют ценность даже после истечения срока эксплуатации. Поступая во вторичную переработку, они используются в различных отраслях промышленности – от нефтехимии до изготовления ювелирных украшений.
Состав автомобильного катализатора
Внутри стального корпуса устройства расположен металлический или керамический носитель из множества ячеек, покрытых напылением из редкоземельных металлов. Палладий, платина, родий характеризуются высокой стоимостью, поскольку получение этих элементов в природе – трудоемкий процесс, отнимающий у добывающих предприятий массу ресурсов. Драгоценное покрытие обеспечивает фильтрацию выхлопов, окисляя вредные компоненты и преображая:
- Углеводород – в водяной пар.
- Азотные оксиды – в азот.
- Угарный газ – в углекислый.
В результате в воздух выбрасываются вещества, не представляющие угрозы для окружающей среды и здоровья человека.
Обратите внимание, что по мере использование ценное напыление стирается – в среднем, катализаторы подлежат замене после прохождения 100 – 120 тысяч километров. Срок службы изделий зависит от изначального количества драгоценных металлов в составе. Самыми «насыщенными» и качественными считаются запчасти импортного производства, которые изготавливаются в соответствии со строгими экологическими требованиями. В России стандарты экологичности продукции пока не так высоки, поэтому отечественные производители нередко заменяют драгметаллы на более дешевые элементы.
Можно ли извлечь металлы из катализатора в домашних условиях
Самостоятельная добыча драгметаллов из автокатализатора – сложная процедура, требующая практических навыков и знаний. Существует несколько технологий извлечения ценных элементов:
- Выщелачивание с помощью окислителей.
- Использование «царской водки».
- Разогрев металла с последующим фторированием.
- Гальванический метод.
Применение этих способов целесообразно лишь в том случае, если вы работаете с крупной партией катализаторов. В противном случае, стоимость продажи металлов не окупят расходы на их получение. Гораздо проще и удобнее сдать отработанные детали в пункт приема металлоконструкций, где всю работу за вас сделают профессиональные сотрудники – вам останется только дождаться оценки драгметаллов и получить вознаграждение.
Понравилась информация? Поделись с друзьями